Hóa 9 bài 9: Tính chất hóa học của Muối, phản ứng trao đổi trong dung dịch ví dụ và bài tập vận dụng. Trong các bài học trước các em đã biết muối được tạo thành trong các phản ứng giữa axit và bazo, hay oxit axit với bazo và oxit bazo với axit, và câu hỏi Muối có tính chất hóa học gì cũng xuất hiện.
Để giải đáp thắc mắc trên, trong bài viết này chúng ta cùng tìm hiểu về tính chất hóa học của Muối, và khái niệm về phản ứng trao đổi trong dung dịch giữa Muối với Axit, Bazơ và Muối, qua đó giải các bài tập về Muối.
– Công thức hóa học của Muối ăn: NaCl
– Công thức hóa học của Muối Iot : NaCl bổ sung lượng nhỏ NaI
– Muối có 5 tính chất hóa học đặc trưng:
- Tác dụng với kim loại
- Tác dụng với bazo
- Tác dụng với axit
- Tác dụng với muối
- Bị nhiệt phân
I. Tính chất hóa học của Muối
1. Muối tác dụng với kim loại
– Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
– Điều kiện để xảy ra phản ứng: Kim loại từ Mg trở đi và phải đứng trước kim loại trong muối (Tính theo dãy hoạt động hóa học của kim loại)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Muối tác dụng với axit
– Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓ trắng
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Muối tác dụng với dung dịch muỗi
– Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ: AgNO3 + NaCl → NaNO3 + AgCl↓ trắng
4. Muối tác dụng với dung dịch bazơ
– Dung dịch bazơ có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓ trắng
5. Muối phản ứng phân hủy muối
– Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ: 2KClO3 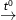 2KCl + 3O2↑
2KCl + 3O2↑
CaCO3 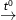 CaO + CO2↑
CaO + CO2↑

II. Phản ứng trao đổi trong dung dịch
1. Phản ứng trao đổi là gì?
– Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
– Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓ xanh lam
K2SO4 + NaOH: Phản ứng không xảy ra.
* Chú ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Ví dụ: H2SO4 + 2NaOH → Na2SO4 + 2H2O
III. Bài tập về Muối và phản ứng trao đổi
Bài 1 trang 33 SGK hóa 9: Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
a) Chất khí.
b) Chất kết tủa.
Viết các phương trình hóa học.
* Lời giải bài 1 trang 33 SGK hóa 9:
a) Tạo ra chất khí, ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
b) Tạo chất kết tủa, ví dụ dung dịch muối (BaCl2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo ra kết tủa trắng BaSO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba(NO3)2 + H2SO4 → BaSO4↓ + HNO3
– Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa trắng.
Ba(NO3)2 + Na2CO3 → BaCO3↓ + 2NaNO3.
Bài 2 trang 33 SGK hóa 9: Có 3 lọ không nhãn, mỗi lọ đựng dung dịch muối sau: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ. Viết các phương trình hóa học.
* Lời giải bài 2 trang 33 SGK hóa 9:
– Trích mẫu thử và đánh số thứ tự:
– Dùng dd NaCl có sẵn trong phòng thí nghiệm lần lượt cho vào từng mẫu thử trên:
+ Có kết tủa trắng xuất hiện đó là sản phẩm của AgNO3.
PTHH: NaCl + AgNO3 → AgCl↓ + NaNO3
+ Không có hiện tượng gì là CuSO4 và NaCl
– Dùng dung dịch NaOH có trong phòng thí nghiệm cho vào 2 mẫu còn lại:
+ Mẫu nào có kết tủa đó là sản phẩm của CuSO4.
PTHH: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
+ Còn lại là NaCl.
Bài 3 trang 33 SGK hóa 9: Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Hãy cho biết muối nào có thể tác dụng với:
a) Dung dịch NaOH.
b) Dung dịch HCl.
c) Dung dịch AgNO3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
* Lời giải bài 3 trang 33 SGK hóa 9:
a) Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2 và CuCl2 vì sinh ra
Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
b) Không muối nào tác dụng với dung dịch HCl.
c) Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng.
CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2.
Bài 4 trang 33 SGK hóa 9: Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng, dấu (o) nếu không:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | ||||
| BaCl2 |
Hãy viết phương trình hóa học ở ô có dấu (x).
* Lời giải bài 4 trang 33 SGK hóa 9:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | x | x | x | o |
| BaCl2 | x | o | x | o |
– Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2NaNO3
Pb(NO3)2 + 2KCl → PbCl2↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl.
Bài 5 trang 33 SGK hóa 9: Ngâm một đinh sắt sạch trong dung dịch đồng (II) sunfat. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
a) Không có hiện tượng nào xảy ra.
b) Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không có sự thay đổi.
c) Một phần đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt và màu xanh của dung dịch ban đầu nhạt dần.
d) Không có chất mới nào được sinh ra, chỉ có một phần đinh sắt bị hòa tan.
Giải thích cho sự lựa chọn đó và viết phương trình phản ứng xảy ra.
* Lời giải bài 5 trang 33 SGK hóa 9:
– Đáp án: C đúng. Một phần đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt và màu xanh của dung dịch ban đầu nhạt dần.
PTPƯ: Fe + CuSO4 → FeSO4 + Cu
– Khi cho đinh sắt vào dung dịch CuSO4, đinh sắt bị hòa tan, kim loại đồng sinh ra bám ngoài đinh sắt, dung dịch CuSO4 tham gia phản ứng (tạo thành FeSO4) nên màu xanh của dung dịch ban đầu sẽ bị nhạt dần.
(Lưu ý: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của chúng)
Bài 6 trang 33 SGK hóa 9: Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7 g AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
* Lời giải bài 6 trang 33 SGK hóa 9:
a) Phương trình phản ứng:
CaCl2 (dd) + 2AgNO3 → 2AgCl ↓ trắng + Ca(NO3)2 (dd)
– Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl kết tủa.
b) Ta có: MCaCl2 = 40 + 35,5. 2 = 111 (g/mol) ; MAgNO3 = 108 + 14 + 16.3 = 170 (g/mol).
⇒ nCaCl2 = (2,22/111) = 0,02 (mol); nAgNO3 = (1,7/170) = 0,01 (mol).
– Tỉ lệ mol theo PTPƯ: 1 mol CaCl2 pư cần 2 mol AgNO3
⇒ nCaCl2 = 0,02/1 > 0,01/2 = nAgNO3
⇒ AgNO3 phản ứng hết, CaCl2 dư.
– Theo PTPƯ: nAgCl = nAgNO3 = 0,01 (mol) ⇒ mAgCl = 0,01. 143,5 = 1,435 (g)
c) Chất còn lại sau phản ứng: Ca(NO3)2 và CaCl2 dư
– Theo PTPƯ: nCaCl2 (pư) = (1/2).nAgNO3 = (1/2).0,01 = 0,005 (mol).
⇒ nCaCl2 (dư) = 0,02 – 0,005 = 0,015 (mol).
– Mặt khác, ta có Vdd = 70 (ml) + 30 (ml) = 100 (ml) = 0,1 (lit)
⇒ CM (CaCl2 dư) = n/V = 0,015/0,1 = 0,15 (M).
– Cũng theo PTPƯ thì: nCa(NO3)2 = nAgNO3 = 0,005 (mol).
⇒ CM (Ca(NO3)2) = 0,005/0,1 = 0,05 (M).
Hy vọng với bài viết về tính chất hóa học của Muối, và khái niệm về phản ứng trao đổi trong dung dịch giữa Muối với Axit, Bazơ và Muối, và giải các bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết để ghi nhận và hỗ trợ, chúc các em học tập tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





