Chương 1 với nội dung về nguyên tử các em đã biết nguyên tử có cấu tạo như thế nào? tạo nên từ các hạt gì? Kích thước, khối lượng, điện tích của chúng ra sao? Hạt nhân nguyên tử được tạo nên từ những hạt nào? Cấu tạo vỏ nguyên tử như thế nào? Mối liên hệ giữa cấu tạo nguyên tử với tính chất của các nguyên tố.
Bài viết dưới đây sẽ giúp các em củng cố kiến thức về thứ tự các phân lớp electron theo chiều tăng năng lượng trong nguyên tử. Số electron tối đa trong một phân lớp, một lớp. Cấu hình electron của nguyên tử.
Đồng thời, rèn luyện kỹ năng xác định số electron của các lớp và số electron lớp ngoài cùng của nguyên tử 20 nguyên tố đầu trong bảng tuần hoàn, từ đó suy ra tính chất cơ bản của nguyên tố.
Bạn đang xem: Bài tập luyện tập Cấu tạo Vỏ nguyên tử – Hóa 10 bài 6
I. Kiến thức cần nắm vững về cấu tạo vỏ nguyên tử
1. Thứ tự các mức năng lượng từ thấp đến cao
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…
2. Số electron tối đa trong một lớp, phân lớp
– Lớp thứ n (n=1,2,3,4) là: 2n2e.
– Phân lớp: s2, p6, d10, f14.
3. Electron có mức năng lượng cao nhất phân bố vào phân lớp nào thì đó chính là họ của nguyên tố.
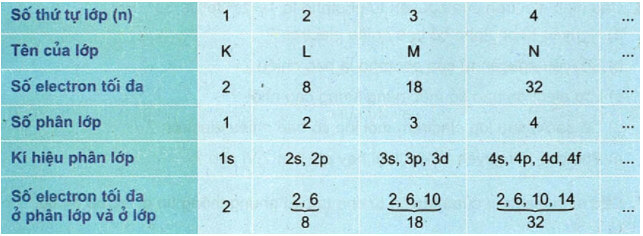 Bảng 3: Lớp và phân lớp electron
Bảng 3: Lớp và phân lớp electron
4. Lớp e ngoài cùng quyết định tính chất hóa học của nguyên tố, sẽ bão hòa bền với 8e( Trừ He, 2e ngoài cùng).
– Nếu số electron thuộc lớp ngoài cùng là 1, 2 hoặc 3e: nguyên tố có tính kim loại
– Nếu số electron thuộc lớp ngoài cùng là 4e: nguyên tố là kim loại nếu có 4 lớp e trở lên, còn lại là phi kim.
– Nếu số electron thuộc lớp ngoài cùng là 5, 6 hoặc 7e: nguyên tố thường có tính phi kim
– Nếu số electron thuộc lớp ngoài cùng là 8e: nguyên tố tương đối trơ về mặt hóa học (nguyên tử của nguyên tố khí hiếm).
 Bảng 4: Mối liênhệ giữa lớp electron lớp ngoài cùng với loại nguyên tố
Bảng 4: Mối liênhệ giữa lớp electron lớp ngoài cùng với loại nguyên tố
* Lưu ý: Cách viết cấu hình electron nguyên tử gồm các bước sau:
– Bước 1: Xác định số electron của nguyên tử
– Bước 2: Các electron được phân số lần lượt vào các phân lớp theo chiều tăng dần của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s…) và tuân theo quy tắc sau:
Phân lớp s chứa tối đa 2 electron;
Phân lớp p chứa tối đa 6 electron;
Phân lớp d chứa tối đa 10 electron;
Phân lớp f chứa tối đa 14 electron;
– Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 2p 3s 3p 3d 4s 4p 4d 5s…)
* Ví dụ: Nguyên tử sắt: Z=26, có 26 electron. Các electron của nguyên tử Fe được phân bố như sau (theo mức năng lượng): 1s22s22p63s23p64s23d6.
Cấu hình electron của nguyên tử Fe là: 1s22s22p63s23p63d64s2.
II. Bài tập luyện tập cấu tạo vỏ nguyên tử
* Bài 1 trang 30 SGK Hóa 10: Thế nào là nguyên tố s, p, d, f?
* Lời giải:
– Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
– Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
– Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
– Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
* Bài 2 trang 30 SGK Hóa 10: Các electron thuộc lớp K hay lớp L liên kết với hạt nhân chặt chẽ hơn? Vì sao?
* Lời giải:
– Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
* Bài 3 trang 30 SGK Hóa 10: Trong nguyên tử, những electron của lớp nào quyết định tính chất hoá học của nguyên tử nguyên tố đó ? Cho thí dụ.
* Lời giải:
– Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử nguyên tố.
– Thí dụ: Liti, natri có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại, oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.
* Bài 4 trang 30 SGK Hóa 10: Vỏ electron của một nguyên tử có 20 electron. Hỏi:
a) Nguyên tử đó có bao nhiêu lớp electron?
b) Lớp ngoài cùng có bao nhiêu electron?
c) Đó là nguyên tố kim loại hay phi kim?
* Lời giải:
– Nguyên tử có 20 electron nên có cấu hình electron: 1s22s22p63s23p64s2.
a) Nguyên tử có 4 lớp electron
b) Lớp ngoài cùng có 2 electron
c) Do nguyên tử nguyên tử có 2e lớp ngoài cùng nên nguyên tố đó là kim loại.
* Bài 5 trang 30 SGK Hóa 10: Cho biết số electron tối đa ở các phân lớp sau:
a) 2s. b) 3p.
c) 4s. d) 3d.
* Lời giải:
a) 2s2. b) 3p6.
c) 4s2. d) 3d10.
* Bài 6 trang 30 SGK Hóa 10: Cấu hình electron của nguyên tử photpho là 1s22s22p63s23p3.Hỏi:
a) Nguyên tử photpho có bao nhiêu electron?
b) Số hiệu nguyên tử của P là bao nhiêu?
c) Lớp electron nào có mức năng lượng cao nhất?
d) Có bao nhiêu lớp, mỗi lớp có bao nhiêu electron?
e) Photpho là nguyên tố kim loại hay phi kim? Cho thí dụ.
* Lời giải:
a) Nguyên tử photpho có 15e
b) Số hiệu nguyên tử của photpho là: 15
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) Có 3 lớp electron:
Lớp thứ nhất có: 2e
Lớp thứ hai có: 8e
Lớp thứ ba có: 5e
e) Photpho là phim kim vì có 5e ở lớp ngoài cùng.
* Bài 7 trang 30 SGK Hóa 10: Cấu hình electron của nguyên tử cho ta những thông tin gì? Cho thí dụ.
* Lời giải:
+ Cấu hình electron nguyên tử cho biết sự phân bố electron trên các lớp và phân lớp. Từ đó dự đoán được nhiều tính chất của nguyên tử nguyên tố.
+ Thí dụ: Nguyên tố Na có cấu hình electron là 1s22s22p63s1
– Cấu tạo nguyên tử: điện tích hạt nhân là 11+, nguyên tử có 3 lớp electron và có 1e ở lớp ngoài cùng.
– Vị trí của nguyên tố trong bảng tuần hoàn: ô số 11, chu kì 3, nhóm IA.
– Tính chất hóa học đặc trưng: do có 1e lớp ngoài cùng nên Na là một kim loại mạnh.
* Bài 8 trang 30 SGK Hóa 10: Viết cấu hình electron đầy đủ cho các nguyên tử có lớp electron ngoài cùng là:
a) 2s1. b) 2s22p3.
c) 2s22p6. d) 3s23p3.
e) 3s23p5. g) 3s23p6.
* Lời giải:
Cấu hình electron đầy đủ cho các nguyên tử:
a) 1s22s1.
b) 1s22s22p3.
c) 1s22s22p6.
d) 1s22s22p63s23p3.
e) 1s22s22p63s23p5.
g) 1s22s22p63s23p6
* Bài 9 trang 30 SGK Hóa 10: Cho biết tên, kí hiệu, số hiệu nguyên tử của:
a) 2 nguyên tố có số electron lớp ngoài cùng tối đa.
b) 2 nguyên tố có 1 electron ở lớp ngoài cùng.
c) 2 nguyên tố có 7 electron ở lớp ngoài cùng.
* Lời giải:
a) 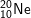 : có cấu hình e: 1s22s22p6 ⇒ có 8e lớp ngoài cùng
: có cấu hình e: 1s22s22p6 ⇒ có 8e lớp ngoài cùng
và 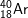 : có cấu hình e: 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
: có cấu hình e: 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
b) 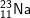 : có cấu hình e: 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
: có cấu hình e: 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
và 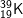 : có cấu hình e: 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
: có cấu hình e: 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
c) 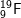 : có cấu hình e: 1s22s22p5 ⇒ có 7e lớp ngoài cùng
: có cấu hình e: 1s22s22p5 ⇒ có 7e lớp ngoài cùng
và 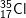 : có cấu hình e: 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
: có cấu hình e: 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
Hy vọng với bài viết Bài tập luyện tập Cấu tạo Vỏ nguyên tử ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để ghi nhận và hỗ trợ, chúc các em học tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





