Ở nội dung các bài trước các em biết các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
Bài học này chúng ta sẽ giải một số bài tập về cấu tạo vỏ nguyên tử qua đó rèn luyện kỹ năng xác định số electron của các lớp và số electron lớp ngoài cùng. Đồng thời củng cố kiến thức về phân lớp electron theo chiều tăng của năng lượng trong nguyên tử; Số electron tối đa trong một phân lớp, một lớp và cấu hình electron của nguyên tử.
I. Cấu tạo vỏ nguyên tử – kiến thức cần nhớ
Bạn đang xem: Bài tập luyện tập Cấu tạo Vỏ nguyên tử – Hóa lớp 10
1. Lớp và phân lớp electron
• Số electron tối đa ở lớp thứ n (1, 2, 3, 4) là: 2n2
• Số electron tối đa ở mỗi phân lớp là: s2; p6; d10; f14.
| Số thứ tự lớp (nn) | 1 | 2 | 3 | 4 |
| Tên của lớp | K | L | M | N |
| Số electron tối đa | 2 | 8 | 18 | 32 |
| Số phân lớp | 1 | 2 | 3 | 4 |
| Kí hiệu phân lớp | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Số electron tối đa ở phân lớp và ở lớp | 2 | (2,6)→8 | (2,6,10)→18 | (2,6,10,14)→32 |
2. Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố
– Lớp electron ngoài cùng quyết định tính chất hóa học của nguyên tố, sẽ bão hòa bền với 8e (trừ heli (He) có 2e ngoài cùng).
| Cấu hình electron lớp ngoài cùng |
ns1 ns2 ns2np1 |
ns2np2 |
ns2np3 ns2np4 ns2np5 |
ns2np6 (He:1s2) |
| Số electron thuộc lớp ngoài cùng | 1, 2 hoặc 3 | 4 | 5, 6 hoặc 7 | 8 (2 ở He) |
| Loại nguyên tố |
Kim loại (trừ H, He, B) |
Có thể là kim loại hoặc phi kim | Thường là phi kim | Khí hiếm |
| Tính chất cơ bản của nguyên tố | Tính kim loại | Có thể là tính kim loại hay tính phi kim | Thường có tính phi kim | Tương đối trơ về mặt hóa học |
II. Bài tập về Cấu tạo vỏ nguyên tử
* Bài 1 trang 30 SGK Hóa 10: Thế nào là nguyên tố s, p, d, f?
* Lời giải Bài 1 trang 30 SGK Hóa 10:
– Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
– Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
– Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
– Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
* Bài 2 trang 30 SGK Hóa 10: Các electron thuộc lớp K hay lớp L liên kết với hạt nhân chặt chẽ hơn? Vì sao?
* Lời giải Bài 2 trang 30 SGK Hóa 10:
– Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
* Bài 3 trang 30 SGK Hóa 10: Trong nguyên tử, những electron của lớp nào quyết định tính chất hóa học của nguyên tử nguyên tố đó? Cho thí dụ.
* Lời giải Bài 3 trang 30 SGK Hóa 10:
– Trong nguyên tử, các electron ở lớp ngoài cùng quyết định tính chất hóa học của nguyên tử nguyên tố.
– Ví dụ: Liti (Li), Natri (Na) có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại; Oxi (O) và Lưu huỳnh (S) đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.
* Bài 4 trang 30 SGK Hóa 10: Vỏ electron của một nguyên tử có 20 electron. Hỏi:
a) Nguyên tử đó có bao nhiêu lớp electron?
b) Lớp ngoài cùng có bao nhiêu electron?
c) Đó là nguyên tố kim loại hay phi kim?
* Lời giải Bài 4 trang 30 SGK Hóa 10:
– Nguyên tử có 20 electron nghĩa là có 20 proton hay số đơn vị điện tích hạt nhân là 20.
– Cấu hình electron: 1s22s22p63s23p64s2.
a) Nguyên tử có 4 lớp electron
b) Lớp ngoài cùng có 2 electron
c) Đó là kim loại.
* Bài 5 trang 30 SGK Hóa 10: Cho biết số electron tối đa ở các phân lớp sau:
a) 2s. b) 3p. c) 4s. d) 3d.
* Lời giải Bài 5 trang 30 SGK Hóa 10:
a) 2s2. b) 3p6. c) 4s2. d) 3d10.
* Lời giải Bài 9 trang 30 SGK Hóa 10:
a) 2 nguyên tố có tối đa 8 electron ở lớp ngoài cùng là:
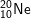 : 1s22s22p6 ⇒ có 8e lớp ngoài cùng
: 1s22s22p6 ⇒ có 8e lớp ngoài cùng
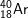 : 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
: 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
b) 2 nguyên tố có 1 electron ở lớp ngoài cùng là:
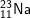 : 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
: 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
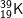 : 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
: 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
c) 2 nguyên tố có 7 electron ở lớp ngoài cùng là:
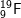 : 1s22s22p5 ⇒ có 7e lớp ngoài cùng
: 1s22s22p5 ⇒ có 7e lớp ngoài cùng
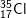 : 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
: 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
Như vậy, với bài viết củng cố lại kiến thức và một số bài tập về cấu tạo vỏ nguyên tử ở trên các em cần ghi nhớ về lớp và phân lớp electron và mối liên hệ giữa electron lớp ngoài cùng với loại nguyên tố. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để ghi nhận và hỗ trợ, chúc các em học tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





