Điều chế kim loại, Sự ăn mòn kim loại và một số bài tập cơ bản là nội dung ở các bài học trước mà các em đã được tìm hiểu.
Trong bài này, chúng ta cùng ôn tập lại các nội dung chính về điều chế kim loại và sự ăn mòn kim loại, đặc biệt là tiếp tục luyện kỹ năng giải bài tập dạng kim loại mạnh khử ion của kim loại yếu hơn trong dung dịch.
I. Tóm tắt lý thuyết Điều chế kim loại và Sự ăn mòn
Bạn đang xem: Bài tập luyện tập Điều chế kim loại và Sự ăn mòn Kim loại – Hóa 12 bài 23
1. Điều chế kim loại
a) Nguyên tắc: Khử ion kim loại thành nguyên tử kim loại
b) Các phương pháp: nhiệt luyện, thủy luyện, điện phân.
2. Sự ăn mòn kim loại
a) Khái niệm: Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh.
b) Phân loại: có 2 dạng ăn mòn kim loại
– Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
– Ăn mòn điện hoá học là quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
c) Chống ăn mòn kim loại: 2 cách thường dùng
– Phương pháp bảo vệ bề mặt
– Phương pháp điện hóa
II. Bài tập luyện tập về điều chế kim loại và sự ăn mòn kim loại
* Bài 1 trang 103 SGK Hóa 12: Bằng những phương pháp hóa học nào có thể điều chế Ag từ dung dịch AgNO3, điều chế Mg từ dung dịch MgCl2? Viết các phương trình hóa học.
° Lời giải bài 1 trang 103 SGK Hóa 12:
• Các phương pháp điều chế Ag từ AgNO3 là:
– Phương pháp nhiệt phân:
AgNO3 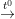 Ag + NO2 + ½O2
Ag + NO2 + ½O2
– Phương pháp thủy luyện:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
– Phương pháp điện phân dung dịch:
4AgNO3 + 2H2O ![small xrightarrow[]{dpdd}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578282555sgk1r4aq4l_1639482861.gif) 4Ag + 4HNO3 + O2
4Ag + 4HNO3 + O2
• Phương pháp điều chế Mg từ MgCl2 là:
MgCl2 ![small xrightarrow[]{dpnc}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578282557mdu0wy2j76_1639482862.gif) Mg + Cl2
Mg + Cl2
* Bài 2 trang 103 SGK Hóa 12: Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
a) Viết phương trình hóa học của phản ứng và cho biết vai trò các chất tham gia phản ứng.
b) Xác định khối lượng của vật sau phản ứng.
° Lời giải bài 2 trang 103 SGK Hóa 12:
a) Phương trình hóa học của phản ứng:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag↓
– Phương trình ion thu gọn:
Cu + 2Ag+ → Cu2+ + 2Ag↓
– Ta thấy, AgNO3 là chất oxi hóa, Cu là chất khử.
b) Theo bài ra, 250g dung dịch AgNO3 4% nên có:
Từ công thức: C% = mct/mdd ⇒ mct = mdd.C%
nên khối lượng chất tan AgNO3 là: mAgNO3 = 250.4% = 10(g).
Vậy ta có: ![]()
– Theo bài ra, thì sau phản ứng khối lượng AgNO3 trong dung dịch giảm 17% (đây là khối lượng AgNO3 tham gia phản ứng), ta có:
![]()
– Theo PTPƯ ta có:
![]()
![]()
⇒ Khối lượng của vật sau phản ứng là:
msau = mCu(dư) + mAg = (10 – 64.0,005 ) + 108.0,01 = 10,76 (g).
* Bài 3 trang 103 SGK Hóa 12: Để khử hoàn toàn 23,2 gam một oxit kim loại cần dùng 8,96 lít H2 (đktc). Khim loại đó là kim loại nào sau đây?
A. Mg. B. Cu. C. Fe. D. Cr.
° Lời giải bài 3 trang 103 SGK Hóa 12:
• Chọn đáp án: C. Fe.
– Gọi công thức của oxit kim loại là MxOy
– Theo bài ra, cần dùng 8,96 lít H2 (đktc) nên số mol H2 là:
![]()
– Phương trình phản ứng:
MxOy + yH2 → xM + yH2O
0,4/y 0,4(mol)
– Theo PTPƯ và theo bài ra có 23,2g oxit tương đương (0,4/y) mol nên khối lượng mol phân tử oxit là:
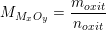
![]()
– Như vậy: Mx + 16y = 58y ⇒ Mx = 42y
⇒ M = 56; x = 3 và y = 4 (thoả)
⇒ Vậy kim loại cần tìm là Fe và công thức oxit là Fe3O4.
* Bài 4 trang 103 SGK Hóa 12: Cho 9,6 gam bột kim loại M vào 500ml dung dịch HCl 1M, sau phản ứng kết thúc thu được 5,376 (lít) H2 (đktc). Kim loại M là kim loại nào sau đây.
A. Mg. B. Cu. C. Fe. D. Cr.
° Lời giải bài 4 trang 103 SGK Hóa 12:
• Chọn đáp án: B. Cu.
– Theo bài ra, thu được 5,376 (lít) H2 (đktc) nên:
![]()
– Cũng theo bài ra, ta có số mol HCl là:
nHCl = 0,5.1 = 0,5(mol)
– Gọi hóa trị của kim loại M là n, ta có phương trình phản ứng:
2M + 2nHCl → 2MCln + nH2
– Số mol HCl tham gia phản ứng là:
nHCl = 2.nH2 = 2.0,24 = 0,48(mol) (như vậy HCl còn dư 0,5 – 0,48 = 0,02mol).
– Từ PTPƯ, ta có số mol của kim loại là: nM = 0,48/n (mol).
– Vậy ta có khối lượng mol phân tử kim loại M là:
![]()
– Biện luận, chọn n=1 ⇒ M = 20 (loại);
chọn n = 2 ⇒ M = 40 (Ca); n=3 ⇒ M = 60 (loại).
⇒ Vậy M là Ca.
* Bài 5 trang 103 SGK Hóa 12: Điện phân nóng chảy muối clorua của kim loại M. Ở catot thu được 6 gam kim loại và ở anot có 3,36 lít khí (đktc) thoát ra. Muối clorua đó là:
A. NaCl. B. KCl. C. BaCl2. D. CaCl2.
° Lời giải bài 5 trang 103 SGK Hóa 12:
• Chọn đáp án: D. CaCl2.
– Phương trình điện phân nóng chảy:
MCln ![small xrightarrow[]{dpnc}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578282557mdu0wy2j76_1639482862.gif) 2M + nCl2
2M + nCl2
– Theo bài ra, ở anot có 3,36 lít khí (đktc) thoát ra là Cl2 nên có:
![]()
![]()
– Vậy ta có khối lượng mol phân tử kim loại M là:
![]()
– Biện luận, chọn n=1 ⇒ M = 20 (loại);
chọn n = 2 ⇒ M = 40 (Ca);
⇒ Vậy M là Ca và muối đó là CaCl2.
Hy vọng với bài viết về Bài tập luyện tập Điều chế kim loại và Sự ăn mòn Kim loại ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





