Các bài học trước các em đã được giới thiệu về thành phần nguyên tử, hạt nhân nguyên tử nguyên tố hóa học và đồng vị.
Bài này sẽ giúp các em củng cố kiến thức về thành phần cấu tạo nguyên tử, hạt nhân nguyên tử, kích thước khối lượng, điện tích của các hạt. Định nghĩa nguyên tố hóa học, ký hiệu nguyên tử, đồng vị, nguyên tử khối trung bình.
I. Kiến thức về thành phần nguyên tử, nguyên tố hóa học
Bạn đang xem: Bài tập luyện tập về thành phần cấu tạo nguyên tử nguyên tố hóa học – Hóa 10 bài 3
1. Nguyên tử được cấu tạo nên bởi electron và hạt nhân. Hạt nhân được tạo nên bởi proton và nơtron
• qe = – 1,602.10-19 C, quy ước bằng 1– ; me = 0,00055u
• qp= +1,602.10-19 C ,quy ước bằng 1+ ; mp = 1u
• qn = 0 ; mn = 1u
2. Trong nguyên tử, số đơn vị điện tích hạt nhân Z = số proton = số electron
• Số khối A = Z + N
• Nguyên tử khối coi như bằng tổng số các proton và các nơtron (gần đúng).
• Nguyên tử khối của một nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của đồng vị đó.
• Nguyên tố hóa học là những nguyên tử có cùng số Z.
• Các đồng vị của một nguyên tố hóa học là các nguyên tử có cùng số Z , khác số N.
3. Số hiệu nguyên tử Z và số khối A đặc trưng cho nguyên tử
• Kí hiệu nguyên tử: 

II. Bài tập về thành phần nguyên tử, nguyên tố hóa học
* Bài 1 trang 18 SGK Hóa 10: Theo số liệu ở bảng 1 Bài 1 trang 8:
a) Hãy tính khối lượng g của nguyên tử nitơ (gồm 7 proton, 7 notron, 7 electron) (Đây là phép tính gần đúng).
b) Tính tỉ số khối lượng của electron trong nguyên tử so với khối lượng của toàn nguyên tử.
* Lời giải:
a) Tổng khối lượng của electron: 7.(9,1.10-28) = 63,7.10-28g
– Tổng khối lượng của proton: 7.(1,67.10-24) = 11,69.10-24g
– Tổng khối lượng của notron: 7.(1,675.10-24) = 11,72.10-24g
⇒ Khối lượng của nguyên tử nitơ: = me + mp + mn = 23,43.10-24g.
b) Tỉ số khối lượng của electron trong nguyên tử so với khối lượng của toàn nguyên tử là:
![]()
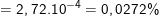
* Bài 2 trang 18 SGK Hóa 10: Tính nguyên tử khối trung bình của kali biết rằng trong tự nhiên thành phần % các đồng vị của kali là:
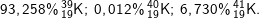
* Lời giải:
– Nguyên tử khối trung bình của kali là:
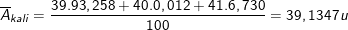
* Bài 3 trang 18 SGK Hóa 10: a) Định nghĩa nguyên tố hóa học.
b) Kí hiệu nguyên tử thể hiện những đặc trưng gì cho nguyên tử một nguyên tố hóa học, lấy thí dụ với nguyên tố kali.
* Lời giải:
a) Nguyên tố hóa học bao gồm các nguyên tử có cùng số đơn vị điện tích hạt nhân.
b) Kí hiệu nguyên tử: 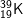
• Kí hiệu trên cho ta biết:
– Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 – 19 = 20) nơtron. Vỏ electron của nguyên tử K có 19 electron.
– Nguyên tử khối của K là 39u.
* Bài 4 trang 18 SGK Hóa 10: Căn cứ vào đâu mà người ta biết chắc chắn rằng giữa nguyên tố hiđro (Z = 1) và nguyên tố urani (Z = 92) chỉ có 90 nguyên tố.
* Lời giải:
– Từ H có Z = 1, urani có Z = 92 có tất cả 92 nguyên tố vì số hiệu của các ô trong bảng tuần hoàn là một dãy số tự nhiên tăng dần và không có ô trống giữa các số này (như số thứ tự). Vậy trừ H và U chỉ còn 90 nguyên tố ở khoảng giữa 2 nguyên tố.
* Bài 5 trang 18 SGK Hóa 10: Tính bán kính gần đúng của nguyên tử canxi biết thể tích của 1 mol canxi tinh thể bằng 25,87 cm3.
(Cho biết: Trong tinh thể, các nguyên tử canxi chỉ chiếm 74% thể tích, còn lại là khe trống).
* Lời giải:
– Ta có: 1 mol chứa khoảng 6,02.1023 nguyên tử nên thể tích của 1 nguyên tử canxi là:
![]()
Mặt khác lại có: 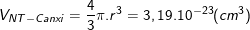
Nên suy ra: ![]()
* Bài 6 trang 18 SGK Hóa 10: Viết công thức của các loại phân tử đồng (II) oxit, biết rằng đồng và oxi có các đồng vị sau:
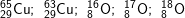
* Lời giải:
– Với 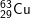 có các oxit sau:
có các oxit sau: 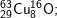
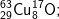
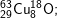
– Với 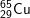 có các oxit sau:
có các oxit sau: 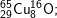
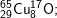
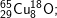
Hy vọng với phần Bài tập luyện tập về thành phần cấu tạo nguyên tử nguyên tố hóa học các em đã rèn luyện được kỹ năng xác định số electron, số proton, số nơtron, và nguyên tử khối khi biết ký hiệu nguyên tử.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





