C6H5OH + Br2 → C6H2Br3OH + HBr được biên soạn giúp các bạn viết và cân bằng đúng phương trình khi cho phenol tác dụng với Br2, phenol có công thức hóa học là C6H5OH. Mời các bạn tham khảo.
1. Phương trình phản ứng Phenol Br2
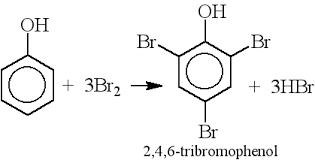
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
↓ trắng
2. Điều kiện phản ứng Phenol và Br2
Không có
Bạn đang xem: C6H5OH + Br2 → C6H2Br3OH + HBr
3. Hiện tượng nhận biết phản ứng
Dung dịch Brom (Br2) bị mất màu, dần xuất hiện kết tủa trắng.
4. Mở rộng phương trình phản ứng Phenol và Br2
Các bạn có thể viết phương trình dưới dạng cấu tạo để có thể thấy rõ cơ chế phản ứng.
5. Bài tập vận dụng liên quan
Câu 1. Phenol không phản ứng với chất nào sau đây?
A. Na.
B. NaOH.
C. NaHCO3.
D. Br2.
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
C6H5OH + Na → C6H5ONa + 1/2H2
C6H5OH + NaOH → C6H5ONa + H2O
Câu 2. Cho các phát biểu sau về phenol:
(a) Phenol vừa tác dụng được với dung dịch NaOH vừa tác dụng được với Na.
(b) phenol tan được trong dung dịch KOH.
(c) Nhiệt độ nóng chảy của phenol lớn hơn nhiệt độ nóng chảy của ancol etylic.
(d) phenol phản ứng được với dung dịch KHCO3 tạo CO2.
(e) Phenol là một ancol thơm.
Trong các trường hợp trên, số phát biểu đúng là
A. 5
B. 2
C. 3
D. 4.
(a) Phenol vừa tác dụng được với dung dịch NaOH vừa tác dụng được với Na.
(b) phenol tan được trong dung dịch KOH.
(c) Nhiệt độ nóng chảy của phenol lớn hơn nhiệt độ nóng chảy của ancol etylic.
Câu 3. Hợp chất hữu cơ X( phân tử chứa vòng benzen) có công thức phân tử là C7H8O2. Khi X tác dụng với Na dư, số mol H2 thu được bằng số mol X tham gia phản ứng. Mặt khác, X tác dụng được với dung dịch NaOH theo tỉ lệ số mol 1 : 1. Công thức cấu tạo thu gọn của X là
A. C6H5CH(OH)2.
B. HOC6H4CH2OH
C. CH3C6H3(OH)2.
D. CH3OC6H4OH.
Chất X phản ứng với Na tạo ra nH2 = nX => có 2 nhóm -OH. X phản ứng với NaOH theo tỉ lệ 1:1 => Có 1 nhóm OH gắn vào nhân thơm.
=> X là: X là HOC6H4CH2OH.
=> Đáp án B
Câu 4. Để nhận biết ba lọ mất nhãn: phenol, stiren, ancol benzylic, người ta dùng một thuốc thử duy nhất là:
A. Na
B. Dung dịch NaOH
C. Nước brom
D. Ca(OH)2
Câu 5. Khi thổi khí CO2 dư vào dd C6H5ONa muối vô cơ thu được phải là NaHCO3 vì:
A. phênol là chất kết tinh, ít tan trong nước lạnh.
B. tính axit của H2CO3 > C6H5OH > HCO3–.
C. CO2 là một chất khí.
D. Nếu tạo ra Na2CO3 thì nó sẽ bị CO2 dư tác dụng tiếp theo phản ứng: Na2CO3 + CO2 + H2O → 2NaHCO3.
Ta có H2CO3 có Ka 1 = 4,2 x 10-7; Ka 2 = 4,8 x 10-11; C6H5OH có
Ka = 1,047 x 10-10
→ tính axit của H2CO3 > C6H5OH > HCO3–
Câu 6. Dung dịch A gồm phenol và xiclohexanol trong hexan (làm dung môi). Chia dung dịch A làm hai phần bằng nhau:
- Phần một cho tác dụng với Na (dư) thu được 3,808 lít khí H2 (đktc).
- Phần hai phản ứng với nước brom (dư) thu được 59,58 gam kết tủa trắng.
Khối lượng của phenol và xiclohexanol trong dung dịch A lần lượt là:
A. 25,38 g và 15 g
B. 16 g và 16,92 g
C. 33,84 g và 32 g
D. 16,92 g và 16 g
Gọi số mol trong 1/2 dung dịch A là: nC6H5OH = x mol; nC6H11OH = y mol
nH2 = 1/2. nC6H5OH + 1/2. nC6H11OH = 0,17 mol ⇒ x + y = 0,34 mol
n↓ = nC6H2OHBr3 = nC6H5OH = 0,18 mol ⇒ x = 0,18 ⇒ y = 0,16
⇒ mphenol = 0,18.94.2 = 33,84g; mxiclohexanol = 0,16.100.2 = 32g
Câu 7. Hãy chọn các phát biểu đúng về phenol (C6H5OH):
(1). phenol có tính axit nhưng yếu hơn axit cacbonic;
(2). phenol làm đổi màu quỳ tím thành đỏ;
(3). hiđro trong nhóm –OH của phenol linh động hơn hiđro trong nhóm –OH của etanol,như vậy phenol có tính axit mạnh hơn etanol;
(4). phenol tan trong nước (lạnh) vô hạn vì nó tạo được liên kết hiđro với nước;
(5). axit picric có tính axit mạnh hơn phenol rất nhiều;
(6). phenol không tan trong nước nhưng tan tốt trong dung dịch NaOH.
A. (1), (2), (3), (6).
B. (1), (2), (4), (6).
C. (1), (3), (5), (6).
D. (1), (2), (5), (6).
(2) sai vì phenol có tính axit rất yếu nên không làm đổi màu quỳ tím.
(4) sai vì phenol tan ít trong nước lạnh, tan vô hạn ở 66oC, tan tốt trong etanol, ete và axeton,…
Có 4 phát biểu đúng là (1), (3), (5), (6)
Câu 8. Phát biểu không đúng là:
A. Dung dịch natri phenolat phản ứng với khí CO2, lấy kết tủa vừa tạo ra cho tác dụng với dung dịch NaOH lại thu được natri phenolat
B. Phenol phản ứng với dung dịch NaOH, lấy muối vừa tạo ra cho tác dụng với dung dịch HCl lại thu được phenol
C. Axit axetic phản ứng với dung dịch NaOH, lấy dung dịch muối vừa tạo ra cho tác dụng với khí CO2 lại thu được axit axetic
D. Anilin phản ứng với dung dịch HCl, lấy muối vừa tạo ra cho tác dụng với dung dịch NaOH lại thu được anilin
Axit axetic mạnh hơn H2CO3 nên CO2 không thể phản ứng được với muối axetat để tạo axit axetic.
Câu 9. Để nhận biết 3 lọ mất nhãn: phenol, stiren, ancol benzylic, người ta dùng một thuốc thử duy nhất là:
A. Na
B. Dung dịch NaOH
C. Nước brom
D. Ca(OH)2
Trích mẫu thử và đánh số thứ tự
Ta dùng nước brom phản ứng lần lượt với 3 lọ mất nhãn
Nếu xuất hiện ↓ → phenol
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
Nếu brom mất màu → stiren:
C6H5CH=CH2 + 3Br2 → C6H5CHBr-CH2Br
Nếu không có hiện tượng gì → ancol benzylic.
Câu 10. Một dung dịch A chứa 5,4 gam chất đồng đẳng của phenol đơn chức. Cho dung dịch M phản ứng với nước brom (dư), thu được 17,25 gam hợp chất B chứa 3 nguyên tử brom trong phân tử, giả sử phản ứng xảy ra hoàn toàn. Công thức phân tử chất đồng đẳng của phenol là
A.(CH3)2C6H3-OH.
B.CH3 -C6H4-OH.
C.C6H5-CH2-OH.
D.C3H7-C6H4-OH.
A + 3Br2 → B+ 3HBr
x 3x 3x
nBr2 = nHBr = xnBr2 = nHBr = x
Áp dụng định luật bảo toàn khối lượng ta có:
mA + mBr2 = mhợp chất + mHBr
=> 5,4 + 160.3x = 17,25 + 81.3x => x = 0,05 mol
=> MA = 5,4/0,05 = 108
=> A chỉ có thể là CH3 -C6H4-OH.
Câu 11. Để điều chế axit picric, người ta cho 7,05 gam phenol tác dụng với HNO3 đặc, H2SO4 đặc. Biết lượng axit HNO3 đã lấy dư 25% so với lượng cần thiết. Số mol HNO3 cần dùng và khối lượng axit picric tạo thành là :
A. 0,5625 mol; 34,75 gam.
B. 0,5625 mol; 34,35 gam.
C. 0,28125 mol; 17,175 gam.
D. 0,45 mol; 42,9375 gam.
Phương trình hóa học:
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Phương trình: 94 → 189 → 229 (g)
Theo đề bài m phenol = 7,05 gam
⇒ mHNO3 = 7,05.189/94 = 14,175 gam ⇒ nHNO3 = 0,225 mol
⇒ nHNO3 dùng = 0,225 + 25%.0,225 = 0,28125 mol
maxit picric = 7,05.229/94 = 17,175 gam
…………………………..
C6H5OH + NaOH → C6H5ONa + H2O
CH3COONa + NaOH → CH4 + Na2CO3
C2H5OH + O2 → CH3COOH + H2O
Trên đây đã giới thiệu tới các bạn C6H5OH + Br2 → C6H2Br3OH + HBr. Để có thể nâng cao kết quả trong học tập, xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 11, Chuyên đề Hóa học 11, Giải bài tập Hoá học 11. Tài liệu học tập lớp 11 mà tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





