PHƯƠNG PHÁP GIẢI BÀI TẬP PHẢN ỨNG NHIỆT NHÔM
I. CƠ SỞ LÍ THUYẾT
1. Khái niệm
Phản ứng nhiệt nhôm là phản ứng của nhôm tác dụng với các oxit kim loại ở nhiệt độ cao
Bạn đang xem: Cách giải nhanh bài toán nhiệt nhôm
Al + oxit kim loại → oxit nhôm + kim loại
(Hỗn hợp X) (Hỗn hợp Y)
2. Dạng thường gặp
2Al + Fe2O3 → Al2O3 + 2Fe
8Al + 3Fe3O4 →4Al2O3 + 9Fe
2yAl + 3FexOy → Al2O3 + 3xFe
2Al + Cr2O3 → Al2O3 + 2Cr
2Al + 3CuO → Al2O3 + 3Cu
– Trường hợp 1: Nếu phản ứng xảy ra hoàn toàn.
+ Hết Al và hết oxit kim loại → Chất rắn Y thu được chỉ có kim loại sinh ra và Al2O3.
+ Al hết, dư oxit kim loại dư → Chất rắn Y thu được Kim loại sinh ra, oxit kim loại và Al2O3.
+ Al dư, oxit kim loại hết → Chất rắn Y thu được Al dư, kim loại sinh ra và Al2O3.
– Trường hợp 2: Nếu phản ứng xảy ra không hoàn toàn, hỗn hợp Y gồm Al2O3, kim loại sinh ra, Al dư và oxit kim loại dư.
3. Phương pháp giải
– Hỗn hợp Y khi tác dụng với dung dịch bazơ kiềm (OH–) giải phóng H2
Al + OH– + H2O → AlO2– + 3/2H2
→ có Al dư số mol Al = 2/3 số mol của H2
– Hỗn hợp Y tác dụng với dung dịch axit có khí bay ra thì lượng H2 thoát ra là của Al và kim loại sinh ra phản ứng (đứng trước H trong dãy hoạt động hóa học).
Al + 3H+ → Al3+ + 3/2H2
M + nH+ →Mn+ + n/2H2
– Ngoài ra, thường sử dụng thêm:
+ Định luật bảo toàn khối lượng: mhhX = mhhY
+ Định luật bảo toàn nguyên tố (mol nguyên tử):
nAl (X) = nAl (Y)
nkl (X) = nkl (Y)
nO (X) = nO (Y)
II. BÀI TẬP VẬN DỤNG
Câu 1: Để khử hoàn toàn mg hỗn hợp CuO và PbO cần 8,1g kim loại nhôm, sau phản ứng thu được 50,2g hỗn hợp 2 kim loại. Giá trị của m là
A. 53,4g
B. 57,4g
C. 54,4g
D. 56,4g
Câu 2: Đun nóng hỗn hợp gồm 10,8g bột Al với 16 bột Fe2O3 (không có không khí), nếu hiệu suất phản ứng là 80% thì khối lượng Al2O3 thu được là:
A. 7,8g
B. 10,2g
C. 8,16g
D. 16,32g
Câu 3: Dùng m (g) Al để khử hoàn toàn một lượng Fe2O3 sau phản ứng thấy khối lượng oxit giảm 0,58 g. Hỏi lượng nhôm đã dùng m =?
A. m = 0,27 g
B. m = 2,7g
C. m = 0,54 g
D. m = 1,12 g.
Câu 4: Trộn 6,48g Al với 16g Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn A. Khi A tác dụng với dung dịch NaOH dư có 1,344 lit khí thoát ra (đkc). Hiệu suất của phản ứng nhiệt nhôm là:
A. 85%
B. 80%
C. 75%
D. 100%
Câu 5: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
A. 45,6.
B. 48,3.
C. 36,7.
D. 57,0.
Bài toán phản ứng nhiệt nhôm
I.Các dạng bài toán trong phản ứng nhiệt nhôm
1.1. Dạng 1: Bài toán có hiệu suất phản ứng không hoàn toàn trong phản ứng nhiệt nhôm
* Phương pháp giải chung
Phản ứng: 2Al + Fe2O3 Al2O3 + 2Fe
– Hiệu suất phản ứng H = %Alphản ứng hoặc = % Fe2O3phản ứng
– Hỗn hợp X sau phản ứng gồm: Al2O3, Fe, Al dư, Fe2O3 thường được cho vào
+ Tác dụng với dung dịch axit (HCl, H2SO4 loãng) tạo khí H2
Fe + 2H+ à Fe2+ + H2 (1)
2Al + 6H+ à 2Al3+ + 3H2 (2)
=> nH2 = nFe + nAldư
+ Nếu hỗn hợp X tác dụng với dung dịch NaOH thì Al và Al2O3 bị phản ứng
2Al dư + 2NaOH + 3H2O à 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O à 2Na[Al(OH)4]
Ví Dụ 1: Trộn 10,8 gam bột nhôm với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hòa tan hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng dư thu được 10,752 lít H2(đktc). Hiệu suất phản ứng nhiệt nhôm? (giả sử Fe3O4 chỉ bị khử thành Fe)
Phân tích
– Với bài tính hiệu suất như bài này HS thường không biết tính hiệu suất theo Al hay Fe3O4 thực tế ở bài này đã biết số mol của Al và Fe3O4 ta cần so sánh tỉ lệ mol các chất để xác định xem hiệu suất của phản ứng tính theo chất nào
– Vì là bài tính hiệu suất nên hỗn hợp A sau phản ứng gồm: Al2O3, Fe, Al dư, Fe3O4 cho vào dung dịch axit (HCl, H2SO4 loãng) tạo khí H2
Fe + 2H+ à Fe2+ + H2 (1)
2Al + 6H+ à 2Al3+ + 3H2 (2)
Fe3O4, Al2O3 + H+ à Muối + H2O
=> nH2 = nFe + nAldư
Hướng dẫn giải:
Theo bài ra ta có nAl = 0,4 mol, n Fe3O4 = 0,15 mol
=> hiệu suất H = %Fe3O4 phản ứng
Phản ứng: 8Al + 3Fe3O4 4Al2O3 + 9Fe
Ban đầu (mol) 0,4 0,15
Phản ứng 8x 3x 9x
Sau phản ứng (0,4-8x) 0,15 – 3x 9x
Theo PT 1,2 ta có nH2 = nFe + nAldư
ó 0,48 = 9x + (0,4 – 8x) => x = 0,04 mol
Vậy hiệu suất H = % Fe3O4 =
Ví Dụ 2: Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Tính giá trị của m?
Phân tích
– Trong bài này phản ứng chỉ xảy ra một thời gian, đề bài cũng không định hướng sản phẩm tạo ra nên hỗn hợp sản phẩm X gồm nhiều chất (Fe, Al2O3, Al dư, Fe3O4 dư, FeO) khi hỗn hợp này tác dụng với dung dịch axit ta tách hỗn hợp X thành 2 phần (Kim loại và oxit kim loại) tác dụng với dung dịch HCl
Phản ứng: 2H+ + O2- (trong oxit) à H2O
2H+ ——–> H2
Dựa vào các định luật BTNT Oxi và hidro để tính số mol HCl
BTKL tính khối lượng muối gồm kim loại và Cl–
Hướng dẫn giải:
Sơ đồ phản ứng:
Al + Fe3O4 ——> hỗn hợp X: Al2O3, Fe3O4, FeO, Fe, Al dư
Hỗn hợp X gồm các oxit và kim loại
BTNT oxi n O (trong X) = n O (Fe3O4) = 0,04 . 4 = 0,16 mol
Phản ứng: 2H+ + O2- (trong oxit) à H2O
2H+ ——–> H2
ð nH+ = 2n O2- + 2n H2 = 2. 0,16 + 2. 0,15 = 0,62 mol
ð nCl– = nH+ = 0,38 mol
ð Áp dụng BTKL: m Muối = mKl + mCl–
=> m Muối = 0,12 . 27 + 0,04 .3. 56 + 0,62 . 35.5 = 31,97 gam
Dạng 2: Bài toán nhiệt nhôm với hiệu suất H = 100%
* Phương pháp giải chung
– Bước 1: Cần xác định được Al dư hay oxit kim loại dư, trường hợp nếu cho khối lượng hỗn hợp cần xét các trường hợp Al dư và Al hết
– Bước 2:
+ Dựa vào các dữ kiện của bài toán thường gặp là hỗn hợp sau phản ứng tác dụng với dung dịch NaOH hoặc dung dịch axit (HCl, H2SO4) tính số mol chất dư và số mol các chất phản ứng
+ Vận dụng bảo toàn nguyên tố Al, Fe, O, bảo toàn khối lượng hoặc bảo toàn electron các các phản để tính toán
– Bước 3: Tính toán theo yêu cầu của bài toán
Ví dụ 1: Nung nóng m gam hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau: Phần 1: tác dụng với dung dịch H2SO4 loãng dư sinh ra 3,08 lít khí H2 (ở đktc) Phần 2: tác dụng với dung dịch NaOH dư sinh ra 0,84 lít khí H2 (ở đktc). Tính giá trị của m?
Hướng dẫn giải:
nH2 (p1) = 0,1375 mol ; nH2 (p2) = 0,0375 mol
– Hỗn hợp rắn Y tác dụng với NaOH giải phóng H2 → Al dư và vì phản ứng xảy ra hoàn toàn nên thành phần hỗn hợp rắn Y gồm: Al2O3, Fe và Al dư
– Gọi nFe = x mol ; nAl dư = y mol có trong 1/2 hỗn hợp Y
– Từ đề ta có hệ phương trình: 2Al + Fe2O3 Al2O3 + 2Fe
– Theo đlbt nguyên tố đối với O và Fe: nAl2O3 = nFe2O3 = 0,05 mol
– Theo đlbt khối lượng: m = (0,05 . 102 + 0,1 . 56 + 0,025 . 27). 2 = 22,75 gam
Ví dụ 2: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Tính giá trị của m?
Hướng dẫn giải:
– Từ đề suy ra thành phần hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
– Các phản ứng xảy ra là:
8Al + 3Fe3O4 —–> 4Al2O3 + 9 Fe
2Al + 2NaOH + 6H2O ——> 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O ——> 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] ——> Al(OH)3 + NaHCO3
– nH2 = 0,15 mol, nAl(OH)3 = 0,5 mol
Theo bảo toàn nguyên tố Al ta có nAl bđ = n ÔAl(OH)3 = 0,5 mol
nAl dư = nH2 = 0,1 mol
=> nAl pư (1) = 0,5 – 0,1 = 0,4mol
Theo Pt (1) nFe3O4 = nAl = 0,15 mol
Vậy khối lượng m = 27. 0,5 + 232 . 0,15 = 48,3 gam
Ví dụ 3: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Tính giá trị của m?
Hướng dẫn giải:
– Từ đề suy ra thành phần hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
– Các phản ứng xảy ra là:
8Al + 3Fe3O4 —–> 4Al2O3 + 9 Fe
2Al + 2NaOH + 6H2O ——> 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O ——> 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] ——> Al(OH)3 + NaHCO3
– nH2 = 0,15 mol, nAl(OH)3 = 0,5 mol
Theo bảo toàn nguyên tố Al ta có nAl bđ = n ÔAl(OH)3 = 0,5 mol
nAl dư = nH2 = 0,1 mol
=> nAl pư (1) = 0,5 – 0,1 = 0,4mol
Theo Pt (1) nFe3O4 = nAl = 0,15 mol
Vậy khối lượng m = 27. 0,5 + 232 . 0,15 = 48,3 gam
Ví dụ 4: Nung hỗn hợp gồm 15,2 gam Cr2O3 (Cr = 52) và m gam Al. Sau phản ứng hoàn toàn, được 23,3 gam hỗn hợp rắn X. Cho toàn bộ X phản ứng với axit HCl dư thoát ra V lít H2 (đktc). Tính giá trị của V?
Hướng dẫn giải:
Ta có nCr2O3 = 0,1 mol
Pư: 2Al + Cr2O3 ——> Al2O3 + 2Cr (1)
Bảo toàn khối lượng ta có m hh = mX = 23,3 gam
ð mAl = 23,3 – 15,2 = 8,1 gam => nAl = 0,3 mol
ð Theo PTPư Al dư => nCr = 2nCr2O3 = 0,2 mol
ð nAl dư = 0,3 – 0,2 = 0,1 mol
pư: Cr + 2HCl ——> CrCl2 + H2 (2)
2Aldư + 6HCl ——> 2AlCl3 + 3H2 (3)
Theo các Pư (2,3) nH2 = nCr + nAl = 0,35 mol
Thể tích H2 VH2 = 7,84 lít
Ví dụ 5: Cho hỗn hợp A gồm Al và một oxit sắt. Chia hỗn hợp A thành 2 phần bằng nhau.
Phần 1: cho tác dụng với dung dịch H2SO4 loãng thu được 6,72 (l) khí (đktc).
Phần 2: Phản ứng nhiệt nhôm hoàn toàn, thu được hỗn hợp B, cho B tác dụng với dung dịch NaOH dư thu được 1,344 lít khí (đktc) sau đó cho tiếp dung dịch H2SO4 loãng, dư được 4,032 lít H2 (đktc). Xác định công thức của oxit sắt?
Hướng dẫn giải:
-Phần 1: 2Al + 3H2SO4 ——> Al2(SO4)3 + 3H2
nAl ban đầu = nH2 = 0,2 mol
– Phần 2: 2yAl + 3FexOy ——> yAl2O3 + 3xFe
Hỗn hợp B gồm: Al2O3, Fe và Al dư
2Al dư + 2NaOH + 6H2O ——> 2NaAl(OH)4 + 3 H2
nAl dư = nH2 = 0,04 mol
nAl pư = 0,2 – 0,04 = 0,16 mol
Theo bảo toàn nguyên tố Al: nAl2O3 = nAl pư = 0,08 mol
Bảo toàn nguyên tố oxi ta có: nO(FexOy) = nO (Al2O3) = 0,08 . 3 = 0,24 mol
-Phần rắn còn lại là Fe tác dụng với H2SO4
=> nFe = nH2 = 0,18 mol
=> FexOy: tỉ lệ: x : y = 0,18 : 0,24 = 3 : 4
Vậy công thức oxit sắt là Fe3O4
II.Bài tập vận dụng
Bài 1. Trộn 8,1 gam Al và 48 gam Fe2O3 rồi cho tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm thu được m gam hỗn hợp rắn. Giá trị của m là:
A. 56,1 gam. B. 61,5 gam C. 65,1 gam D. 51,6 gam
Bài 2. Dùng m gam Al để khử hoàn toàn một lượng Fe2O3 sau phản ứng thấy khối lượng oxit giảm 0,58 g. Hỏi lượng nhôm đã dùng m là:
A. m = 0,27 g B. m = 2,7g C. m = 0,54 g D. m = 1,12 g. Bài 3. (ĐH A-2012) Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al, Fe, Fe3O4 và Al2O3. B. Al2O3, Fe và Fe3O4.
C. Al2O3 và Fe. D. Al, Fe và Al2O3.
Bài 4:Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2 Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là:
A. 0,3 mol B. 0,6 mol C. 0,4 mol D. 0,25 mol
Bài 5: Nung m gam hỗn hợp Al, Fe2O3 đến phản ứng hoàn toàn thu được hỗn hợp rắn Y. Chia Y làm 2 phần bằng nhau. Phần 1 tác dụng với dung dịch H2SO4 loãng dư, sinh ra 3,08 lít khí H2 ở đktc. Phần 2 tác dụng với dung dịch NaOH dư, sinh ra 0,84 lít khí H2 ở đktc. Giá trị của m là
A. 21,40 B. 29,40 C. 29,43 D. 22,75
Bài 6: Hỗn hợp X gồm Al, Fe2O3 có khối lượng 21,67 gam. Tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ xảy ra phản ứng khử Fe2O3 thanh Fe) Hòa tan hỗn hợp chất rắn sau phản ứng bằng dung dịch NaOH dư thu được 2,016 lít khí H2 (đktc) và 12,4 gam chất rắn không tan. Hiệu suất của phản ứng nhiệt nhôm là
A. 45% B. 50% C. 71,43% D . 75%
Bài 7: Có 9,66 gam hỗn hợp bột nhôm và Fe3O4. Tiến hành nhiệt nhôm hoàn toàn rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl được 2,688 lít H2 (đktc). Khối lượng nhôm trong hỗn hợp ban đầu là?
A. 2,16 B. 2,7 C. 2,88 D. 0,54
Câu 8: Dùng m gam Al để khử hết 1,6 gam Fe2O3 đến phản ứng hòa toàn, sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m.
Câu 9: khi nung hoàn toàn hỗn hợp A gồm x gam Al và y gam Fe2O3 thu được hỗn hợp B. Chia B thành hai phần bằng nhau: Phần 1 tan trong dung dịch NaOH dư, không có khí thoát ra và còn lại 4,4 gam chất rắn không tan. Phần 2 trong dung dịch H2SO4 loãng dư thu được 1,12 lít khí(đktc). Giá trị của y là
A. 5,6 gam B. 11,2 gam C. 16 gam D. 8 gam
Bài 10: Nung Al và Fe3O4 (không có không khí, phản ứng xảy ra hoàn toàn) thu được hỗn hợp A. Nếu cho A tác dụng với dung dịch KOH dư thì thu được 0,672 lít khí (đktc). Nếu cho A tác dụng với H2SO4 đặc, nóng dư được 1,428 lít SO2 duy nhất (đktc). % khối lượng Al trong hỗn hợp ban đầu là:
A. 33,69% B. 26,33% C. 38,30% D. 19,88%
III.Đáp án
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | C | B | A | D | D | B | A | B | C |
Một số chú ý khi giải bài tập:
– Phản ứng nhiệt nhôm: Al + oxit kim loại oxit nhôm + kim loại
(Hỗn hợp X) (Hỗn hợp Y)
– Thường gặp:
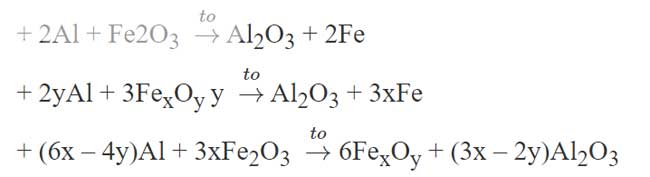
– Nếu phản ứng xảy ra hoàn toàn, tùy theo tính chất của hỗn hợp Y tạo thành để biện luận. Ví dụ:
+ Hỗn hợp Y chứa 2 kim loại → Al dư ; oxit kim loại hết
+ Hỗn hợp Y tác dụng với dung dịch bazơ kiềm (NaOH,…) giải phóng H2 → có Al dư
+ Hỗn hợp Y tác dụng với dung dịch axit có khí bay ra thì có khả năng hỗn hợp Y chứa (Al2O3 + Fe) hoặc (Al2O3 + Fe + Al dư) hoặc (Al2O3 + Fe + oxit kim loại dư)
– Nếu phản ứng xảy ra không hoàn toàn, hỗn hợp Y gồm Al2O3, Fe, Al dư và Fe2O3 dư
– Thường sử dụng:
+ Định luật bảo toàn khối lượng: mhhX = mhhY
+ Định luật bảo toàn nguyên tố (mol nguyên tử):
nAl (X) = nAl (Y) ; nFe (X) = nFe (Y) ; nO (X) = nO (Y)
Một số ví dụ minh họa
Ví dụ 1: Nung nóng m gam hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn , thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
• Phần 1: tác dụng với dung dịch H2SO4 loãng (dư) sinh ra 3,08 lít khí H2 (ở đktc)
• Phần 2: tác dụng với dung dịch NaOH (dư) sinh ra 0,84 lít khí H2 (ở đktc) Giá trị của m là:
A. 22,75 gam B. 21,40 gam C. 29,40 gam D. 29,43 gam
Lời giải
nH2(1) = 0,1375 mol ; nH2(2) = 0,0375 mol
– Hỗn hợp rắn Y tác dụng với NaOH giải phóng H2 → Al dư và vì phản ứng xảy ra hoàn toàn nên thành phần hỗn hợp rắn Y gồm: Al2O3, Fe và Al dư
– Gọi nFe = x mol ; nAl dư = y mol có trong 1/2 hỗn hợp Y
– Từ đề ta có hệ phương trình:
– Theo đlbt nguyên tố đối với O và Fe: nAl2O3 = nFe2O3 = = 0,05 mol
– Theo đlbt khối lượng: m = (0,05.102 + 0,1.56 + 0,025.27).2 = 22,75 gam → đáp án A
Ví dụ 2: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
A. 45,6 gam B. 57,0 gam C. 48,3 gam D. 36,7 gam
Lời giải
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
– Từ đề suy ra thành phần hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
– Các phản ứng xảy ra là:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
– nH2 = 0,15 mol → y = 0,1 mol
– Theo đlbt nguyên tố đối với Al: 2x + y = 0,5 → x = 0,2 mol
– Theo đlbt nguyên tố đối với O: nO(FeO) = nO(AlO) → nFe3O4 = mol
– Theo đlbt nguyên tố đối với Fe: nFe = 3nF3O4 = 3.0,15 = 0,45 mol
– Theo đlbt khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam →đáp án C
Ví dụ 3: Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và một oxit sắt FexOy (trong điều kiện không có không khí) thu được 92,35 gam chất rắn Y. Hòa tan Y trong dung dịch NaOH (dư) thấy có 8,4 lít khí H2 (ở đktc) thoát ra và còn lại phần không tan Z. Hòa tan 1/2 lượng Z bằng dung dịch H2SO4 đặc, nóng (dư) thấy có 13,44 lít khí SO2 (ở đktc) thoát ra. Biết các phản ứng xảy ra hoàn toàn. Khối lượng Al2O3 trong Y và công thức oxit sắt lần lượt là:
A. 40,8 gam và Fe3O4 B. 45,9 gam và Fe2O3
C. 40,8 gam và Fe2O3 D. 45,9 gam và Fe3O4
Lời giải
nH2 = 0,375 mol ; nSO2(cả Z) = 2.0,6 = 1,2 mol
– Từ đề suy ra thành phần chất rắn Y gồm: Fe, Al2O3, Al dư và phần không tan Z là Fe
– nH2 = 0,375 mol → nAl dư = 0,25 mol
– nSO2 = 1,2 mol → nFe = mol
– mAl2O3 = 92,35 – 0,8.56 – 0,25.27 = 40,8 gam (1) → nAl2O3 = 0,4 mol
– Theo đlbt nguyên tố đối với O → nO(FeO) = 0,4.3 = 1,2 mol
– Ta có: → công thức oxit sắt là Fe2O3 (2)
– Từ (1) ; (2) → đáp án C
Ví dụ 4: Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
A. 75 % và 0,54 mol B. 80 % và 0,52 mol
C. 75 % và 0,52 mol D. 80 % và 0,54 mol
Lời giải
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
– Phản ứng xảy ra không hoàn toàn: 8Al + 3Fe3O4 4Al2O3 + 9Fe
x→ 0,5x (mol)
– Hỗn hợp chất rắn gồm:
– Ta có phương trình: .2 + (0,2 – x).3 = 0,24.2 → x = 0,16 mol → Hphản ứng =% (1)
– nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
→ nH2SO4phản ứng = mol (2)
– Từ (1) ; (2) → đáp án D
BÀI TẬP ÁP DỤNG
Câu 1: Trộn 10,8 gam bột nhôm với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiẹt nhôm thu được hỗn hợp A. hòa tan hết A bằng HCl thu được 10,752 lít H2(đktc). Hiệu suất phản ứng nhiệt nhôm và thể tích dung dịch HCl 2M cần dùng là
A. 80% và 1,08lít B. 20% và 10,8lít C. 60% và 10,8lít D. 40% và 1,08lít
Câu 2: nung hỗn hợp A gồm Al, Fe2O3 được hỗn hợp B (hiệu suất 100%). Hòa tan hết B bằng HCl dư được 2,24 lít khí (đktc), cũng lượng B này nếu cho phản ứng với dung dịch NaOH dư thấy còn 8,8g rắn C. Khối lượng các chất trong A là?
A. mAl=2,7g, mFe2O3=1,12g B. mAl=5,4g, mFe2O3=1,12g
C. mAl=2,7g, mFe2O3=11,2g D. mAl=5,4g, mFe2O3=11,2g
Câu 3: Hỗn hợp A gồm 0,56g Fe và 16g Fe2O3 m (mol) Al rồi nung ở nhiệt độ cao không có không khí được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được v(lít) khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Gía trị của m là?
A. 0,1233 B. 0,2466 C. 0,12 D. 0,3699
Câu 4: Có 26,8g hỗn hợp bột nhôm và Fe2O3. Tiến hành nhiệt nhôm cho tới hoàn toàn rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl được 11,2 lít H2(đktc). Khối lượng các chất trong hỗn hợp ban đầu là?
A. mAl=10,8g;m=1,6g B. mAl=1,08g;m=16g
C. mAl=1,08g;m=16g D. mAl=10,8g;m=16g
ĐÁP ÁN
1. A 2. A 3.B 4.D




























Phản ứng nhiệt nhôm tổng quát:
Al + oxit kim loại → oxit nhôm + kim loại
(hỗn hợp X) (hỗn hợp Y)

Pt (1) hỗn hợp sau phản ứng có 3
- Al và Fe2O3 phản ứng vừa đủ → sản phẩm gồm Al2O3, Fe
- Al dư → sản phẩm gồm: Al2O3, Fe, Al dư
- Fe2O3 dư → sản phẩm gồm Al2O3, Fe, Fe2O3 dư
Tùy theo tính chất của hỗn hợp Y tạo thành để biện luận.
Ví dụ:
+ Hỗn hợp Y chứa 2 kim loại → Al dư ; oxit kim loại hết
+ Hỗn hợp Y tác dụng với dung dịch bazơ kiềm (NaOH,…) giải phóng H2 → Al dư
+ Hỗn hợp Y tác dụng với dung dịch axit luôn có khí bay ra
Phương pháp giải:
– Bảo toàn khối lượng: mhhX = mhhY
– Bảo toàn nguyên tố: nAl (X) = nAl (Y) ; nFe (X) = nFe (Y) ; nO (X) = nO (Y)
– Bảo toàn electron:
+ Cho Al dư tác dụng với dd NaOH sinh ra H2: 3.nAl dư = 2.nH2
+ Hỗn hợp sau phản ứng (Al dư, Fe, oxit) tác dụng với H+ : 3.nAl dư + 2.nFe = 2.nH2
+ Hh sau phản ứng gồm kim loại và oxit kim loại
2H+ + O2- →→ H2O
2H+ + 2e →→ H2
=> nH+ pứ = 2.nO (trong oxit) + 2.nH2
Phản ứng nhiệt nhôm và cách giải bài tập
Phản ứng nhiệt nhôm là gì?
Như đã định nghĩa ở đầu bài, phản ứng nhiệt nhôm là một loại phản ứng ở nhiệt độ cao giữa nhôm với oxit hoặc với các chất khác. Với vai trò là chất khử, phản ứng này sinh nhiều nhiệt và tạo ra các đơn chất kim loại. Ta cùng tìm hiểu phản ứng nhiệt nhôm qua một số phương trình giữa nhôm với các axit;
Nhôm phản ứng oxit sắt: 2yAl + 3FexOy → yAl2O3 + 3xFe
Đây là phản ứng đặc trưng và có nhiều ứng dụng nhất. Cụ thể là hỗn hợp tạo thành gồm (Fe và Al2O3 dùng để hàn vá đường ray tàu lửa)
Phản ứng nhiệt nhôm điều chế kim loại nào?
Sau khi tìm hiểu dãy hoạt động hóa học của kim loại thì chúng ta đã dần nắm được các qui luật về độ phản ứng mạnh hay yếu của kim loại. Cụ thể trong trường hợp này, nhôm đẩy được các kim loại khác ra khỏi oxit phải thõa mãn điều kiện: Đó phải là các kim loại trung bình hoặc yếu (từ Zn trở đi). Bạn hoàn toàn có thể dùng dãy hoạt động hóa học để tìm hiểu các kim loại này nếu vẫn chưa nhớ.
Lưu ý khi giải bài tập nhiệt nhôm
Khi tiến hành giải bài tập này, các em học sinh cần phải lưu ý một số điểm quan trọng dưới đây:
+ Nếu hỗn hợp sau khi phản ứng ta cho tác dụng với dung dịch kiềm sinh ra khí H2 thì Al còn dư sau phản ứng nhiệt nhôm hoặc hiệu suất H của phản ứng
+ Khi phản ứng kết thúc mà không thấy khí bay lên thì tức là Al không dư và phản ứng thì xảy ra hoàn toàn
+ Tổng khối lượng hỗn hợp trước phản ứng = tổng khối lượng hỗn hợp sau phản ứng. (Định luật bảo toàn khối lượng)
+ Áp dụng định luật bảo toàn electron.
+ Gỉa thiết cho phản ứng xảy ra hoàn toàn → Thì chất rắn chắc chắn có Al2O3 , Fe và có thể Al hoặc FexOy dư. Gỉa thiết không nói đến hoàn toàn, hoặc bắt tính hiệu xuất thì các bạn nên nhớ đến trường hợp chất rắn sau phản ứng có cả 4 chất Al, FexOy, Al2O3, Fe.
Bài tập phản ứng nhiệt nhôm có lời giải
Câu 1: Khi cho 41,4 gam hỗn hợp X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư), sau phản ứng thu được chất rắn có khối lượng 16 gam. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm, phải dùng 10,8 gam Al. Thành phần phần trăm theo khối lượng của Cr2O3 trong hỗn hợp X là (Cho: hiệu suất của các phản ứng là 100%; O = 16; Al = 27; Cr = 52; Fe = 56)
A. 50,67%.
B. 20,33%.
C. 66,67%.
D. 36,71%.
Lời giải:
Khi cho hỗn hợp X tác dụng với NaOH ta thu được các phương trình hóa học sau:
Cr2O3 + 2NaOH → 2NaCrO2+ H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Vì Fe2O3 không phản ứng với dung dịch kiềm, nên khối lượng chất rắn còn lại là Fe2O3
m Fe2O3 = 16 gam, từ đó tính được số mol của oxit sắt III: → n Fe2O3 = 16/160 = 0,1 mol
Tiến hành phản ứng nhiệt nhôm X:
Cr2O3 + 2Al → Al2O3 + 2Cr (1)
Fe2O3 + 2Al → Al2O3 + 2Fe (2)
0,1 mol
Theo đầu bài cho thì số mol Al cần phản ứng sẽ bằng: nAl = 10.8/27 = 0.4 mol
Theo phương trình số 2 khi cân bằng số mol thì nAl = 2.nFe3O4 = 0,2 mol
Do đó, Số mol còn lại của Al trong phương trình (1) là: nAl (1) = 0.4 – 0.2 = 0.2 mol
Dễ dàng suy ra:
n Cr2O3 = 0.1 mol ——> m = 15.2 gam
Phần trăm oxit crom trong hỗn hợp là: % Cr2O3 = 15.2 / 41.4 = 36.71 % —-> Chọn đáp án trắc nghiệm là D.
Câu 2: Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
– Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
– Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc).
Giá trị của m là
A. 22,75
B. 21,40.
C. 29,40.
D. 29,43.
Lời giải:
Đầu tiên ta xác định được đây là dạng toán liên quan đến phản ứng nhiệt nhôm giữa Al và oxit sắt II. Phương trình phản ứng:
2Al + Fe2O3 —-> Al2O3 + 2Fe (1)
Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc):
Al + NaOH + H2O NaAlO2 + 3/2H2
x 1.5 x mol
x = 0.025 mol
Phần (1) tác dụng với H2SO4 ta được các phương trình sau:
2Al + 3H2SO4 ————-> Al2(SO4)3 + 3H2
0.025 0.0375
Fe + H2SO4 l ——————-> FeSO4 + H2
y = 0.1 mol
2Al + Fe2O3 —————–> Al2O3 + 2Fe (1)
0.1 mol 0.05 mol 0.1 mol
Khối lượng của Al : m (Al) = (0,1 +0,025).27 = 3,375
Khối lượng của Fe2O3 : m(Fe2O3) = 0,05.160 = 8 →
Suy ra tổng khối lượng của chất rắn là: m = 11,375.2 = 22,75 (gam)
Vậy đáp án đúng của bài tập này là A. 22,75 gam
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





