Hoá 12 bài 21: Cách điều chế kim loại và bài tập về điều chế kim loại. Như các em đã biết kim loại đóng vai trò quan trọng trong đời sống thức tế, các nguyên tố kim loại cũng chiếm hơn 80% trong bảng tuần hoàn hệ thống các nguyên tố
Vậy làm sao để điều chế được kim loại, có bao nhiêu phương pháp để điều chế kim loại, các phương pháp điều chế kim loại có phải đều giống nhau hay không, chúng ta cùng tìm hiểu qua bài viết này.
I. Nguyên tắc điều chế kim loại
– Nguyên tắc chung là khử ion kim loại thành kim loại
Mn+ + ne → M
II. Một số phương pháp điều chế kim loại
– Tuỳ thuộc vào độ hoạt động hoá học của kim loại mà người ta sử dụng phương pháp điều chế phù hợp
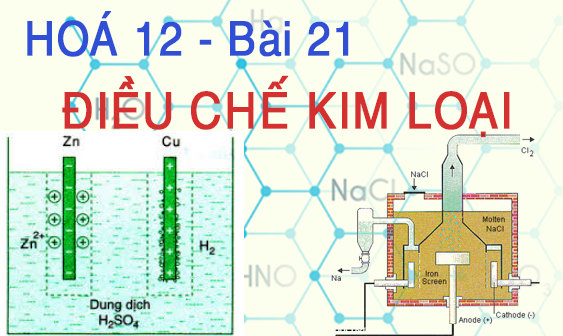
1. Phương pháp nhiệt luyện
– Nguyên tắc: dùng chất khử CO, C, Al, H2 khử oxit kim loại ở nhiệt độ cao.
– Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al như Zn, Fe, Sn, Pb,…
* Ví dụ:
Fe2O3 + 3CO ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) 2Fe + 3CO2
2Fe + 3CO2
PbO + C ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) Pb + CO
Pb + CO
Bạn đang xem: Hoá 12 bài 21: Cách điều chế kim loại và bài tập về điều chế kim loại
Fe2O3 + 3CO ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) 2Fe + 3CO2
2Fe + 3CO2
WO3 + 3H2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) W + 3H2O
W + 3H2O
TiCl4 + 4Na ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) Ti + 4NaCl
Ti + 4NaCl
V2O5 + 5Ca ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316876r9algh0k14_1639483837.gif) 2V + 5CaO
2V + 5CaO
– Các phản ứng dùng kim loại kiềm và kim loại kiềm thổ làm chất khử đều phải thực hiện trong môi trường khí trơ hoặc chân không.
– Trường hợp quặng là sunfua kim loại như Cu2S, ZnS, FeS2,… thì phải chuyển sunfua kim loại thành oxit kim loại. Sau đó khử oxit kim loại bằng chất khử thích hợp, ví dụ với ZnS:
2ZnS + 3O2 → 2ZnO + 2SO2
ZnO + C → Zn + CO
– Đối với kim loại khó nóng chảy như Cr, người ta dùng Al làm chất khử (phản ứng nhiệt nhôm). Phản ứng nhiệt nhôm tỏa nhiệt mạnh, lượng nhiệt tạo ra được sử dụng để đun nóng chảy Cr2O3, nhờ vậy giảm được chi phí cho nhiên liệu:
Cr2O3 + 2Al → 2Cr + Al2O3
– Đối với những kim loại kém hoạt động như Hg, Ag chỉ cần đốt cháy quặng cũng thu được kim loại mà không cần dùng chất khử:
HgS + O2 → Hg + SO2
2. Phương pháp thủy luyện
– Nguyên tắc: dùng dung dịch thích hợp (HCl, HNO3, H2SO4, NạOH, NACN,…) hòa tan nguyên liệu sau đó lấy kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi dung dịch của nó.
– Phạm vi sử dụng: thường dùng trong phòng thí nghiệm để điều chế các kim loại sau Mg (thường là kim loại yếu).
* Ví dụ 1: Người ta điều chế Ag bằng cách nghiền nhỏ quặng bạc sunfua Ag2S, xử lí bằng dung dịch NaCN, rồi lọc để thu được dung dịch muối phức bạc:
Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
– Sau đó, ion Ag+ trong phức được khử bằng kim loại Zn:
Zn + 2Na[Ag(CN)2] → Na2[Zn(CN)4] + 2Ag↓
* Ví dụ 2: Vàng lẫn trong đất đá có thể hòa tan dần trong dung dịch NaCN cùng với oxi của không khí, được dung dịch muối phức của vàng:
4Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH
– Sau đó, ion Au3+ trong phức được khử bằng kim loại Zn:
Zn + 2Na[Au(CN)2] → Na2[Zn(CN)4] + 2Au↓
3. Phương pháp điện phân
a) Điện phân nóng chảy
– Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
– Phạm vi sử dụng: có thể dùng để điều chế tất cả các kim loại nhưng thường dùng với kim loại mạnh: K, Na, Mg, Ca, Ba và Al.
* Ví dụ: Điện phân Al2O3 nóng chảy để điều chế Al
– ở catot (cực âm): Al3+ + 3e → Al
– ở anot (cực dương): 2O2- → O2 + 4e
Al2O3 ![small xrightarrow[]{dpnc}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316878wr4jtnybpj_1639483838.gif) 4Al + 3O2
4Al + 3O2
b) Điện phân dung dịch
– Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
– Phạm vi sử dụng: Dùng điều chế các kim loại yếu.
* Ví dụ: Điện phân dung dịch CuCl2 để điều chế Cu
– ở catot (cực âm): Cu2+ + 2e → Cu
– ở anot (cực dương): 2Cl– → Cl2 + 2e
CuCl2![small small xrightarrow[]{dpdd}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1548464706r2ycad6888_1578316878_1639483838.gif) Cu + Cl2
Cu + Cl2
III. Bài tập Điều chế kim loại
* Bài 2 trang 98 sgk hóa 12: Từ Cu(OH)2, MgO, Fe2O3 hãy điều chế các kim loại tương ứng bằng phương pháp thích hợp. Viết phương trình hóa học của phản ứng.
° Lời giải bài 2 trang 98 sgk hóa 12:
* Từ Cu(OH)2 điều chế Cu
Cu(OH)2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316878q1gictg0pa_1639483839.gif) CuO + H2O
CuO + H2O
CuO + H2 → Cu + H2O
* Từ MgO điều chế Mg
MgO + 2HCl → MgCl2 + H2O
MgCl2 ![small xrightarrow[]{dpnc}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/15783168782hfn90qkqt_1639483839.gif) Mg + Cl2
Mg + Cl2
* Từ Fe2O3 điều chế Fe
Fe2O3 + 3H2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316878q1gictg0pa_1639483839.gif) 2Fe + 3H2O
2Fe + 3H2O
* Bài 3 trang 98 sgk hóa 12: Một loại quặng sắt chứa 80% Fe2O3 và 10% SiO2. Hàm lượng các nguyên tử Fe và Si trong quặng này là :
A. 56% Fe và 4,7% Si
B. 54% Fe và 3,7% Si
C. 53% Fe và 2,7% Si
D. 52% Fe và 4,7% Si
° Lời giải bài 3 trang 98 sgk hóa 12:
* Đáp án: A. 56% Fe và 4,7% Si
– Giả sử có 100 gam quặng sắt, khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
– Theo bài ra, số mol Fe2O3 là nFe2O3 = 80/160 = 0,5(mol).
⇒ nFe = 2.nFe2O3 = 2.0,5 = 1(mol)
⇒ mFe = 1.56 = 56(g)
⇒ %mFe = (56/100).100% = 56%
Tương tự tính cho Si , %Si = 4,7%
* Bài 4 trang 98 sgk hóa 12: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3,Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là :
A. 28g. B. 26g. C. 24g. D. 22g.
° Lời giải bài 4 trang 98 sgk hóa 12:
* Đáp án: B. 26g
– Theo bài ra, ta có: nCO = 5,6/22,4 = 0,25 mol
– Áp dụng định luật bảo toàn khối lượng ta có :
30 + mCO = m + mCO2
⇒ m = 30 + 0,25.28 – 0,25.44 = 26 (g)
* Bài 5 trang 98 sgk hóa 12: Điện phân (điện cực trơ) dung dịch muối sunfua của một kim loại hóa trị II với dòng điện cường độ 3A. Sau khi 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam.
a) Viết phương trình hóa học của phản ứng xảy ra tại mỗi điện cực và phương trình hóa học chung của sự điện phân.
b) Xác định tên kim loại.
° Lời giải bài 5 trang 98 sgk hóa 12:
a) Phương trình hoá học của phản ứng (kim loại là M hoá trị II) nên:
– Tại catot (-): M2+ + 2e → M
– Tại anot (+): 2H2O → 4H+ + O2 + 4e
2MSO4 + 2H2O ![small xrightarrow[]{dpdd}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578316879yvgnim9bsa_1639483839.gif) 2M + 2H2SO4 + O2
2M + 2H2SO4 + O2
– Theo định luật Faraday ta có khối lượng thoát ra ở điện cực là:
![]() =Cu
=Cu
⇒ Kim loại là Cu
* Ở công thức trên: A là nguyên tử khối của kim loại,
I là dòng điện chạy qua dung dịch điện phân
t là thời gian điện phân (tính theo s)
F=96500
n là hóa trị của kim loại
m tính bằng gam (g)
Hy vọng với bài viết về phương pháp điều chế kim loại và bài tập áp dụng ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để được hỗ trợ. Nếu thấy bài viết hay hãy thích và chia sẻ nhé, chúc các em học tập tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





