Hóa 8 bài 36: Tính chất hóa học, công thức cấu tạo của Nước H2O và bài tập vận dụng. Nước H2O là một trong những chất rất quen thuộc và đóng vai trò quan trọng trong đời sống thực tế, nước tham gia vào nhiều quá trình hóa học quan trọng của con người cũng như động thực vật khác.
Vậy nước H2O có thành phần cấu tạo như thế nào, tính chất hóa học và tính chất vật lý ra sao? Có vai trò gì và được ứng dụng vào lĩnh vực nào trong đời sống sản xuất, chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Thành phần cấu tạo của NƯỚC H2O
– Nước là hợp chất được tạo bởi 2 nguyên tố là Hidro và Oxi (H và O) chúng đã hóa hợp với nhau với tỉ lệ thể tích là 1 phần khí O2 với 2 phần khí H2 (tỉ lệ khối lượng là 1 phần Hidro và 8 phần Oxi) có công thức phân tử là H2O.
1. Sự phân hủy nước
– Khi cho dòng điện một chiều đi qua Nước, trên bề mặt 2 điện cực sẽ sinh ra Hidro và Oxi.
2H2O –điện phân→ 2H2 + O2
2. Sự tổng hợp nước
– Đốt hỗn hợp H2 và O2 bằng tia lửa điện gây nổ và 1 thể tích khí Oxi sẽ hóa hợp với 2 thể tích khí Hidro để tạo thành nước.
2H2 + O2 ![small xrightarrow[]{t^{0}}](http://thcs-thptlongphu.edu.vn/wp-content/uploads/2023/03/1557055290bbdwk13jrm.gif) 2H2O
2H2O
II. Tính chất vật lý của Nước H2O
– Nước là chất lỏng không màu, không mùi, không vị, sôi ở 100°C (ở áp suất khí quyển là 760 mm Hg), hóa rắn ở 0°C thành nước đá và tuyết.
– Khối lượng riêng của nước ở 4°C là 1 g/ml (hoặc 1 kg/lít).
– Nước có thể hòa tan được nhiều chất rắn (đường, muối ăn,…) chất lỏng (axit, cồn,..) và chất khí (Hidroclorua HCl, Amoniac NH3,…)
III. Tính chất hóa học của Nước H2O
1. Nước tác dụng với Kim loại
– Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca,… tạo thành bazơ và khí H2.
• H2O + Kim loại → Bazơ + H2↑
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
2. Nước tác dụng với Oxit bazo
– Nước tác dụng với Oxit bazo tạo thành bazơ tương ứng, dung dịch bazơ làm quỳ tím chuyển màu xanh.
• H2O + Oxit → Bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
3. Nước tác dụng với Oxit axit
– Nước tác dụng với Oxit axit tạo thành Axit tương ứng, dung dịch axit làm quỳ tím chuyển màu đỏ.
• H2O + Oxit axit → Axit
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
IV. Vai trò và ứng dụng của Nước
– Nước hoà tan nhiều chất dinh dưỡng cần thiết cho cơ thể sống
– Nước tham gia và nhiều quá trình hoá học quan trọng trong cơ thể người và động vật.
– Nước rất cần thiết cho đời sống hàng ngày, sản suet nông nghiệp, công nghiệp, xây dung, giao thông vận tải.
* Lưu ý: để giữ nguồn nước không bị ô nhiễm cần
– Không thải rác xuống sông, hồ, kênh, ao..
– Xử lý nước thải sinh hoạt và nước thải công nghiệp trước khi cho chảy vào hồ, sông.
V. Bài tập về Nước
Bài 1 trang 125 sgk hóa 8: Dùng từ, cụm từ [Oxit axit, oxit bazơ, nguyên tố, hiđro, oxi, kim loại] để điền vào chỗ trống trong các câu sau:
– Nước là hợp chất tạo bởi hai … là … và … Nước tác dụng với một số … ở nhiệt độ thường và một số … tạo ra bazơ; tác dụng với nhiều … tạo ra axit.
* Lời giải bài 1 trang 125 sgk hóa 8:
– Nước là hợp chất tạo bởi hai nguyên tố là oxi và hiđro. Nước tác dụng với một số kim loại ở nhiệt độ thường và một số oxit bazơ tạo nên bazơ; tác dụng với oxit axittạo ra axit.
Bài 2 trang 125 sgk hóa 8: Bằng những phương pháp nào có thể chứng minh được thành phần định tính và định lượng của nước? Viết các phương trình hóa học xảy ra?
* Lời giải bài 2 trang 125 sgk hóa 8:
– Bằng phương pháp phân hủy nước bằng dòng điện hoặc tổng hợp nước (thực nghiệm) để chứng minh thành phần định tính và định lượng của nước, phương trình hóa học như sau:
2H2O – điện phân→ 2H2↑ + O2↑
2H2 + O2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_05/15570563469zzonq2a21.gif) 2H2O
2H2O
Bài 3 trang 125 sgk hóa 8: Tính thể tích khí hiđro và oxi(đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
* Lời giải bài 3 trang 125 sgk hóa 8:
– Theo bài ra, cần tạo ra 1,8g nước, nên ta có: 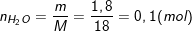
– Phương trình phản ứng:
2H2 + O2 → 2H2O.
– Theo PTPƯ, thì ta có:
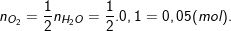
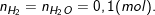
⇒ Thể tích Oxi ở ĐKTC là: VO2 = n.22,4 = 0,05.22,4 = 1,12(lít).
⇒ Thể tích Hidro ở ĐKTC là: VH2 = n.22,4 = 0,01.22,4 = 2,24(lít).
Bài 4 trang 125 sgk hóa 8:Tính khối lượng nước ở trạng thái lỏng sẽ thu được khí đốt cháy hoàn toàn 112l khí hiđro (đktc) với oxi?
* Lời giải bài 4 trang 125 sgk hóa 8:
– Theo bài ra, đốt cháy 112 lít khí khí Hidro, nên có: ![]()
– Phương trình hóa học phản ứng tổng hợp nước:
2H2 + O2 → 2H2O.
– Theo PTPƯ: nH2O = nH2 = 5 (mol).
⇒ mH2O= n.M = 5.18 = 90(g).
⇒ Vì khối lượng riêng của nước là 1g/ml nên thể tích nước lỏng thu được là 90ml.
Bài 5 trang 125 sgk hóa 8: Viết phương trình các phản ứng hóa học tao ra bazơ và axit. Làm thế nào để nhận biết được dung dịch axit và dung dịch bazơ?
* Lời giải bài 5 trang 125 sgk hóa 8:
– Phương trình hóa học các phản ứng tạo ra bazơ và axit:
2Na + 2H2O → 2NaOH + H2↑
Na2O + H2O → 2NaOH.
SO3 + H2O → H2SO4.
P2O5 + 3H2O → 2H3PO4.
* Nhận biết dung dịch axit:
– Làm quỳ tím chuyển màu đỏ.
– Tác dụng với kim loại, muối cacbonat có khí bay lên.
* Nhận biết dung dịch bazơ:
– Quỳ tím chuyển màu xanh.
– Phenolphtalein không màu chuyển sang màu hồng.
Hy vọng với bài viết chi tiết về tính chất hóa học, công thức phân tử của nước ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để ghi nhận và hỗ trợ, chúc các em học tập tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





