Hóa 9 bài 12: Sơ đồ mối quan hệ và dãy chuyển hóa giữa các Hợp chất Vô cơ. Giữa các hợp chất vô cơ như Oxit, Axit, Bazo, Muối có sự chuyển đổi hóa học qua lại với nhau, loại hợp chất vô cơ này có thể chuyển đổi thành loại hợp chất vô cơ khác.
Vậy sơ đồ mối quan hệ hay dãy chuyển hóa giữa các hợp chất vô cơ này như thế nào? điều kiện cho sự chuyển đổi từ chất vô cơ thành chất vô cơ khác là gì? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Sơ đồ mối quan hệ (dãy chuyển hóa) giữa các hợp chất vô cơ
• Như các em đã biết, hợp chất vô cơ này có thể chuyển đổi thành loại hợp chất vô cơ khác, sơ đồ sau thể hiện mối quan hệ giữa các hợp chất vô cơ:
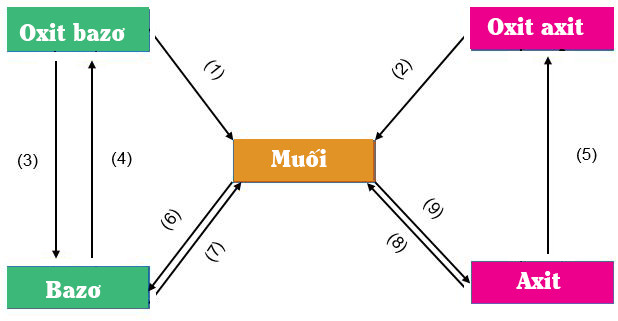
• Điều kiện của phản ứng chuyển đổi giữa các chất vô cơ
– Sản phẩm phải có 1 chất kết tủa hoặc chất bay hơi
– Axit mới sinh ra yếu hơn axit tham gia phản ứng
II. Các phản ứng minh họa sự chuyển đổi giữa các hợp chất vô cơ
– Sự chuyển hóa giữa các hợp chất vô cơ là đa dạng và phức tạp, dưới đây là các phản ứng minh họa cho sơ đồ dãy chuyển hóa ở trên.
(1) CaO(r) + 2HCl(dd) → CuCl2(dd) + H2O(l)
(2) CO2(k) + 2NaOH(dd) → Na2CO3(dd) + H2O(l)
(3) K2O(r) + H2O(l) → 2KOH(dd)
(4) Cu(OH)2(dd) → CuO(r) + H2O(l)
(5) SO3(k) + H2O(l) → H2SO4(dd)
(6) Mg(OH)2(r) + H2SO4(dd) → MgSO4(dd) + 2H2O(l)
(7) CuSO4(dd) + 2NaOH(dd) → Cu(OH)2(r) + Na2SO4(dd)
(8) AgNO3(dd) + HCl(dd) → AgCl(r) + HNO3(dd)
(9) H2SO4(dd) + ZnO(r) → ZnSO4(dd) + H2O(l)
* Một số lưu ý:
– Một số oxit kim loại như Al2O3, MgO, BaO, CaO, Na2O, K2O,… không bị khử bởi H2 hay CO.
– Các oxit kim loại khi ở trạng thái hóa trị cao là oxit axit như: CrO3, Mn2O7,…
– Các phản ứng hóa học xảy ra phải tuân theo các điều kiện của từng phản ứng.
– Khi các oxit axit tác dụng với dung dịch kiềm thì tùy theo tỉ lệ số mol sẽ tạo ra muối axit hay muối trung hòa, ví dụ:
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
– Khi tác dụng với axit sunfuric đặc (H2SO4 đặc) kim loại sẽ thể hiện hóa trị cao nhất và không giải phóng khí Hidro (H2), ví dụ:
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
III. Bài tập vận dụng mối liên hệ giữa các hợp chất vô cơ
° Bài 1 trang 41 SGK Hóa 9: Một trong những thuôc thử nào sau đây có thể dùng phân biệt dung dịch natri sunfat và dung dịch natri cacbonat:
a) Dung dịch bari clorua.
b) Dung dịch axit clohiđric.
c) Dung dịch chì nitrat.
d) Dung dịch bạc nitrat.
e) Dung dịch natri hiđroxit.
Giải thích và viết phương trình hóa học.
* Lời giải bài 1 trang 41 SGK Hóa 9:
+ Thuốc thử b) dung dịch axit clohiđric.
– Dung dịch HCl tác dụng với Na2CO3 tạo khí CO2 bay lên còn Na2SO4 không tác dụng, PTPƯ như sau:
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
– Không nên dùng thuốc thử d) dung dịch AgNO3. Vì hiện tượng quan sát sẽ không rõ rệt: Ag2CO3 không tan và Ag2SO4 ít tan.
° Bài 2 trang 41 SGK Hóa 9: a) Cho các dung dịch sau đây phản ứng vời nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng xảy ra, dấu (0) nếu không có phản ứng:
| NaOH | HCl | H2SO4 | |
| CuSO4 | |||
| HCl | |||
| Ba(OH)2 |
b) Viết các phương trình hóa học (nếu có).
* Lời giải bài 2 trang 41 SGK Hóa 9:
a) Ta có bảng sau:
| NaOH | HCl | H2SO4 | |
| CuSO4 | x | 0 | 0 |
| HCl | x | 0 | 0 |
| Ba(OH)2 | 0 | x | x |
b) Các phương trình phản ứng:
CuSO4 + 2NaOH → Cu(OH)2↓xanh + Na2SO4
HCl + NaOH → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4↓trắng + 2H2O.
° Bài 3 trang 41 SGK Hóa 9: Viết phương trình hóa học cho những chuyển đổi hóa học sau:

* Lời giải bài 3 trang 41 SGK Hóa 9:
a) Ta có chuỗi phương trình phản ứng sau:
(1) Fe2(SO4)3 + 3BaCl2 → 3BaSO4 ↓ + 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
(3) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
(4) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
(5) 2Fe(OH)3 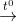 Fe2O3 + 3H2O
Fe2O3 + 3H2O
(6) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
b) Ta có chuỗi phương trình phản ứng sau:
(1) 2Cu + O2 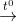 2CuO
2CuO
(2) CuO + H2 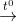 Cu + H2O
Cu + H2O
(3) CuO + 2HCl → CuCl2 + H2O
(4) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
(5) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
(6) Cu(OH)2 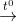 CuO + H2O
CuO + H2O
° Bài 4 trang 41 SGK Hóa 9: Có những chất: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl.
a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển hóa.
b) Viết phương trình hóa học cho mỗi dãy chuyển hóa.
* Lời giải bài 3 trang 41 SGK Hóa 9:
a) Dãy chuyển đổi các chất đã cho có thể:
Na –(1)→ Na2O –(2)→ NaOH –(3)→ Na2CO3 –(4)→ NaCl –(5)→ Na2SO4
b) Các phương trình hóa học:
4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl.
Hy vọng với bài viết về Sơ đồ mối quan hệ và dãy chuyển hóa giữa các Hợp chất Vô cơ cùng bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận để ghi nhận và hỗ trợ, chúc các em học tập tốt!
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





