Hóa học 11 Bài 40: Ancol được biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 40
I. Định nghĩa, phân loại, đồng phân và danh pháp
1. Định nghĩa
Ancol là những hợp chất hữu cơ mà phân tử có nhóm hidroxyl (OH) liên kết trực tiếp với nguyên tử cacbon no.
Công thức tổng quát của ancol: R(OH)n (n ≥ 1), với R là gốc hiđrocacbon.
– Công thức của ancol no mạch thẳng, đơn chức: CnH2n+1OH hay CnH2n+2O (với n ≥ 1).
2. Phân loại
– Gốc R có thể là mạch hở no hay chưa no hoặc mạch vòng.
Ví dụ: CH3-OH; CH2=CH-CH2-OH; C6H5-CH2-OH.
– Nhóm OH- có thể dính vào cacbon bậc 1, bậc 2, bậc 3 tạo thành ancol tương ứng bậc 1, bậc 2, bậc 3.
Lưu ý: Bậc của ancol bằng bậc của nguyên tử cacbon liên kết với nhóm OH.
Ví dụ:
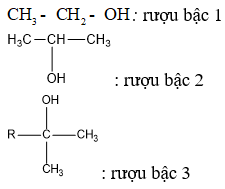
Bảng phân loại ancol

– Ancol không bền khi:
+ Nhiều nhóm –OH cùng đính vào một nguyên tử cacbon.
+ Nhóm –OH đính vào nguyên tử cacbon có nối đôi.
Ví dụ:

3. Đồng phân và danh pháp
a. Đồng phân
– Mạch cacbon khác nhau.
– Vị trí của các nhóm –OH khác nhau.
– Ngoài ra ancol đơn chức có đồng phân là ete: R-O-R’.
Ví dụ: Viết đồng phân của C3H8O.

b. Danh pháp
– Tên thông thường: Tên ancol = tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ:
CH3-CH2-OH: ancol etylic.
CH3-OH: ancol metylic.
– Tên thay thế: Tên ancol = tên gốc hiđrocacbon no tương ứng + ol.
Ví dụ:

II. Tính chất vật lý
– Các ancol có nhiệt độ sôi cao hơn các hiđcacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kết hiđro → Ảnh hưởng đến độ tan.
– Từ C1 đến C12 ancol ở thể lỏng (khối lượng riêng d < 1), từ C13 trở lên ở thể rắn.
– C1 đến C3 tan vô hạn trong nước vì có liên kiết H với nước.
– Độ rượu = (Vancol nguyên chất/Vdd ancol).100
– Các poli như etylen glicol, glixerol thường sánh, nặng hơn nước và có vị ngọt.
III. Tính chất hóa học
1. Phản ứng thế nguyên tử hiđro của nhóm OH ancol (phản ứng đặc trưng của Ancol)
– Tính chất chung của ancol:
2ROH + Na → 2RONa + H2↑
– Tính chất đặc trưng của glixerol:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau)
→ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH
– Phản ứng với axit vô cơ:
![]()
– Phản ứng tạo dien: dùng sản xuất cao su buna.
![]()
(ĐK: phải có xúc tác là Al2O3 + MgO hoặc ZnO/500ºC)
3. Phản ứng tách nước (phản ứng đêhidrat hoá)
Chú ý:
![]()
(ĐK n ≥ 2, theo quy tắc Zai-xép)
(ancol bậc càng cao thì càng dễ khử nước tạo anken)
![]()
(phải là rượu no, đơn chức)
![]()
(ancol bậc càng thấp thì càng dễ khử nước tạo ete)

4. Phản ứng oxi hoá
– Phản ứng oxi hoá hoàn toàn:
![]()
– Phản ứng oxi hoá không hoàn toàn:

IV. Ứng dụng và điều chế
1. Ứng dụng
2. Điều chế
a. Phương pháp tổng hợp
Ví dụ: Điều chế etanol từ etilen CH2=CH2 + H2O → CH3CH2OH
b. Phương pháp sinh hoá: từ tinh bột, đường, …
![]()
c. Điều chế metanol trong công nghiệp

* Giới thiệu một số rượu
a. Rượu metylic (CH3OH)
– Là chất lỏng, không màu, nhẹ hơn nước, tan vô hạn trong nước, có mùi đặc trưng, nhiệt độ sôi 65oC.
– Rất độc: nếu uống phải dễ mù mắt, uống nhiều có thể gây tử vong.
– Dùng để điều chế anđehit fomic, tổng hợp chất dẻo, làm dung môi.
– Điều chế:
+ trực tiếp:
![]()
+ Bằng cách trưng gỗ.
b. Rượu etylic (C2H5OH)
– Là chất lỏng, nhẹ hơn nước, tan vô hạn trong nước, có mùi thơm, nhiệt độ sôi 78oC.
– Có ứng dụng rất lớn trong thực tế: để chế tạo cao su và một số chất tổng hợp khác như este, axit axetic, ete, … Để làm dung môi hòa tan vecni, dược phẩm, nước hoa.
c. Rượu butylic (C4H9OH)
– Có 4 đồng phân. Là những chất lỏng, ít tan trong nước hơn 3 chất đầu dãy đồng đẳng. Có mùi đặc trưng.
d. Rượu allylic (CH2=CH-CH2OH)
– Là chất lỏng không màu, mùi xốc, nhiệt độ sôi 97oC.
– Được dùng để sản xuất chất dẻo.
– Khi oxi hóa ở vị trí nối đôi tạo thành glixerol.
e. Một số rượu đa chức

Giải bài tập SGK Hóa học 11 Bài 40
Bài 1 (trang 186 SGK Hóa 11)
Viết công thức cấu tạo và gọi tên các ancol đồng phân có công thức phân tử C5H12O?
Lời giải:
– Công thức cấu tạo và gọi tên:


Bài 2 (trang 186 SGK Hóa 11)
Viết phương trình hóa học của phản ứng propan-1-ol với mỗi chất sau:
a. Natri kim loại.
b. CuO, đun nóng
c. Axit HBr, có xúc tác
Trong mỗi phản ứng trên ancol giữ vai trò gì: chất khử, chất oxi hoá, axit, bazơ? Giải thích.
Lời giải:
a) 2CH3-CH2-CH2OH + 2Na → 2CH3-CH2-CH2ONa + H2↑
Ancol đóng vai trò chất oxi hóa
b) CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O
Ancol đóng vai trò chất khử
c) CH3-CH2-CH2OH + HBr → CH3-CH2-CH2Br + H2O
Ancol đóng vai trò bazơ
Bài 3 (trang 186 SGK Hóa 11)
Trình bày phương pháp hoá học để phân biệt các chất lỏng đựng trong các lọ không dán nhãn: etanol, glixerol, nước và benzen.
Lời giải:

Bài 4 (trang 186 SGK Hóa 11)
Từ propen và các chất vô cơ cần thiết có thể điều chế được các chất nào sau đây: propan-2-ol (1); propan-1,2-điol (2). Viết các phương trình hoá học của phản ứng xảy ra.
Lời giải:

Bài 5 (trang 187 SGK Hóa 11)
Cho 12,20 gam hỗ hợp X gồm etanol và propan-1-ol tác dụng với Na (dư) thu được 2,80 lit khí đktc.
a. Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp X?
b. Cho hỗn hợp X qua ống đựng CuO, đun nóng. Viết các phương trình hoá học của phản ứng xảy ra.
Lời giải:
a) Gọi số mol của etanol và propan-1-ol lần lượt là x và y (mol)
Phương trình phản ứng:

b) Phương trình phản ứng:
CH3-CH2OH + CuO 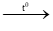
CH3-CH2-CH2OH + CuO 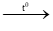
Bài 6 (trang 187 SGK Hóa 11)
Oxi hoá hoàn toàn 0,60(g) một ancol A đơn chức bằng oxi không khí, sau đó dẫn sản phẩm qua bình (1) đựng H2SO4 đặc rồi dẫn tiếp qua bình (2) đựng KOH. Khối lượng bình (1) tăng 0,72g; bình (2) tăng 1,32g.
a. Giải thích hiện tượng thí nghiệm trên bằng phương trình hoá học.
b. Tìm công thức phân tử, viết công thức cấu tạo có thể có của A.
c. Khi cho ancol trên tác dụng với CuO, đun nóng thu được một anđehit tương ứng. Gọi tên của A?
Lời giải:
a.

⇒ nH2O > nCO2
⇒ A là ancol no và theo đầu bài là đơn chức
Gọi công thức phân tử của A là CnH2n+2O (n ≥ 1)

b. CTCT có thể có của A là:
CH3-CH2-CH2-OH, CH3-CH(OH)-CH3
c. Khi cho A tác dụng với CuO, đun nóng được một anđehit ⇒ A là Ancol bậc 1
⇒ CTCT của A là: CH3-CH2-CH2-OH (propan-1-ol)
Bài 7 (trang 187 SGK Hóa 11)
Từ 1,00 tấn tinh bột chứa 5,0% chất xơ (Không bị biến đổi) có thể sản xuất đưuọc bao nhiêu lit etanol tinh khiết, biết hiệu suất chung của cả quá trình là 80,0% và khối lượng riêng của etanol là D = 0,789 g/ml.
Lời giải:
(C6H10O5)n + nH2O → nC6H12O6 (1)
C6H12O6 → 2C2H5OH + 2CO2 (2)
mxơ = 0,05. 106 (g)
⇒ Khối lượng tinh bột = 1.106 – 0,05.106 = 0,95.106 (g)
Từ (1) và (2) ta có:
![]()


Mà hiệu suất chung của cả quá trình sản xuất là 80% nân thể tích etanol thực tế thu được là:

Bài 8 (trang 187 SGK Hóa 11)
Cho ancol

Tên gọi nào dưới đấy ứng với ancol trên?
A. 2-metylpentan-1-ol ;
B. 4-metylpentan-1-ol
C. 4-metylpentan-2-ol ;
D. 3-metylpentan-2-ol
Lời giải:
Đáp án B
Bài 9 (trang 187 SGK Hóa 11)
Cho 3,70gam một ancol X no, đơn chức, mạch hở tác dụng với Na dư có thấy 0,56 lit khí thoát ra (ở đktc). Công thức phân tử của X là:
A. C2H6O
B. C3H10O
C. C4H10O
D. C4H8O
Hãy chọn đáp án đúng
Lời giải:
– Đáp án C

2R-OH + 2Na → 2R-ONa + H2↑
0,05 ← 0,025 (mol)
Theo pt nR-OH = 2. nH2 = 2. 0,025 = 0,05 mol

Ancol no đơn chức có công thức CnH2n + 1OH → 14n + 18 = 74 → n = 4
Vậy công thức phân tử của X là: C4H10O
Trắc nghiệm Hóa học 11 Bài 40 có đáp án
Bài 1: Khi tách nước từ một chất X có công thức phân tử C4H10O tạo thành ba anken là đồng phân của nhau ( tính cả đồng phân hình học). Công thức cấu tạo thu gọn của X là
A. (CH3)2COH).
B. CH3OCH2CH2CH3.
C. CH3CH(OH)CH2CH3.
D. CH3CH(CH3)CH2OH.
Lời giải
Đáp án: C
Bài 2: Tách nước hỗn hợp gồm ancol etylic và ancol Y chỉ tạo ra 2 anken. Đốt cháy cùng số mol mỗi ancol thì lượng nước sinh ra từ ancol này bằng 5/3 lần lượng nước sinh ra từ ancol kia. Ancol Y là
A. CH3-CH2-CH(OH)-CH3.
B. CH3-CH2-CH2-OH.
C. CH3-CH2-CH2-CH2-OH
D. CH3-CH(OH)-CH3.
Lời giải
Đáp án: C
Bài 3: Khi phân tích thành phần một ancol đơn chức X thì thu được kết quả: tổng khối lượng của cacbon và hiđro gấp 3,625 lần khối lượng oxi. Số đồng phân ancol ứng với công thức phân tử của X là
A. 3
B. 4
C. 2
D. 1.
Lời giải
Đáp án: B
Gọi công thức của X là CxHyO
Ta có: 12x + y = 58 ⇒ CTPT của X là C4H10O
Bài 4: Hai ancol nào sau đây cùng bậc ?
A. propan-2-ol và I-phenyletan-I-ol
B. propan-I-ol và phenyletan-I-ol
C. etanol và propan-2-ol
D. propan-2-ol và 2-metylpropan-2-ol.
Lời giải
Đáp án: A
Bài 5: Trong các loại anncol no, đơn chức có số nguyên tố cacbon lớn hơn 1 sau đây, ancol nào khi tách nước (xt H2SO4 đặc, 170oC) luôn thu được 1 ankan duy nhất
A. ancol bậc III.
B. ancol bậc I
C. ancol bậc II.
D. ancol bâc I và bậc III
Lời giải
Đáp án: B
Bài 6: Sản phẩm chính thu được khi tách nước từ 3-metylbutan-2-ol là
A. 3-metylbut-1-en
B. 2-metylbut-2-en.
C. 3-metylbut-2-en.
D. 2-metylbut-3-en
Lời giải
Đáp án: B
Bài 7: Hai ancol X, Y đều có CTPT C3H8O số anken thu được khi đun hỗn hợp X và Y với dung dịch H2SO4 đặc ở nhiệt độ cao là
A. 1
B. 3
C. 2
D. 4.
Lời giải
Đáp án: A
Bài 8: Đốt cháy hoàn toàn m gam hỗn hợp 3 ancol đơn chức, thuộc cùng dãy dồng đẳng thu được 3,808 lít khí CO2 (đktc) và 5,4 gam H2O. Giá trị của m là
A. 5,42
B. 5,72
C. 4,72
D. 7,42.
Lời giải
Đáp án: C
⇒ nCO2 = 0,17 mol; nH2O = 0,3 mol
⇒ m = 0,17.12 + 0,3.2 + (0,3 – 0,17).16 = 4,72 (gam)
Bài 9: Từ 180 gam glucozo, bằng phương pháp lên men rượu, thu được a gam ancol etylic (hiệu suất 80%). Oxi hóa 0,1a gam ancol etylic bằng phương pháp lên men giấm, thu được hỗn hợp X. đẻ trung hòa hỗn hợp X cần 720 ml dung dịch NaOH 0,2M. Hiệu suất quá trình lên men giấm là
A. 90%
B. 80%
C. 75%
D. 72%.
Lời giải
Đáp án: A
C6H12O6 → 2C2H5OH → 2CH3COOH
CH3COOH + NaOH → CH3COONa + H2O
nNaOH = 0,72.0,2 = 0,144 (mol)
Ta có: 0,1.2.0,8.h/100 = 0,144 ⇒ h = 90%
Bài 10: Thực hiện phản ứng lên men m gam glucozơ thu được 750 ml rượu 10o. Biết khối lượng riêng của rượu là: 0,7907 g/ml và hiệu suất phản ứng lên men rượu là 60%. Giá trị m là:
A. 193,35
B. 139,21
C. 210
D. 186,48
Lời giải
Đáp án:
Vrượu = 750.10/100 = 75ml ⇒ mrượu = 59,3025g
C6H12O6 → 2C2H5OH
180 → 92 (gam)
Bài 11: Tên thay thế của C2H5OH là
A. ancol etylic
B. ancol metylic
C. etanol
D. metanol.
Lời giải
Đáp án: C
Bài 12: Số đồng phân cấu tạo của C4H10O là
A. 3
B. 4
C. 6
D. 7.
Lời giải
Đáp án: D
Bài 13: Cho các ancol sau: CH3OH, C2H5OH, HOCH2-CH2OH, HOCH2-CH2-CH2OH, CH3-CH(OH)-CH2OH.
Số anncol cho ở trên phản ứng được với Cu(OH)2 ở nhiệt độ thường là
A. 2
B. 3
C. 4
D. 5
Lời giải
Đáp án: A
Bài 14: Oxi hóa ancol nào sau đây không tạo anđehit ?
A. CH3OH.
B. (CH3)2CHCH2OH.
C. C2H5CH2OH
D. CH3CH(OH)CH3.
Lời giải
Đáp án: D
Bài 15: Hiđrat hóa 2 anken chỉ tạo thành 2 ancol. Hai anken đó là
A. 2-metylpropen và but-I-en.
B. propen và but-2-en.
C. eten và but-2-en
D. eten và but-I-en.
Lời giải
Đáp án: C
******************
Trên đây là nội dung bài học Hóa học 11 Bài 40: Ancol do biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Ancol Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp



