Hóa học 9 Bài 22: Luyện tập chương 2: Kim loại được biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 22
1. Dãy hoạt động hóa học của kim loại
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
2. Tính chất vật lý của kim loại
– Tính dẻo
– Tính dẫn điện
– Tính dẫn nhiệt
– Có ánh kim
3. Tính chất hóa học của kim loại
– Tác dụng với phi kim
– Tác dụng với axit
– Tác dụng với dung dịch muối
Ngoài ra một số kim loại như Al, Zn … có thể tác dụng với dung dịch kiềm.
Giải bài tập SGK Hóa học 9 Bài 22
Bài 1 (trang 69 SGK Hóa 9)
Hãy viết hai phương trình hóa học trong mỗi trường hợp sau đây :
– Kim loại tác dụng với oxi tạo thành oxit bazơ.
– Kim loại tác dụng với phi kim tạo thành muối.
– Kim loại tác dụng với dung dịch axit tạo thành muối và giải phóng khi hiđro.
– Kim loại tác dụng với udng dịch muối tạo thành muối mới và kim loại mới.
Lời giải:
Hai phương trình hóa học của mỗi trường hợp :
a) Kim loại tác dụng với oxi tạo thành oxit bazơ :
3Fe + 2O2 → Fe3O4(nhiệt độ cao)
2Mg + O2 → 2MgO(nhiệt độ cao)
b) Kim loại tác dụng với phi kim tạo thành muối:
2Fe + 3Cl2 → 2FeCl3(nhiệt độ cao)
2Al + 3S → Al2S3(nhiệt độ cao)
c) Kim loại tác dụng với dung dịch axit tạo thành muối và giải phóng khi hiđro:
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
d) Kim loại tác dụng với udng dịch muối tạo thành muối mới và kim loại mới:
Fe + CuSO4 → FeSO4 + Cu ↓
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag ↓ .
Bài 2 (trang 69 SGK Hóa 9)
Hãy xem xét các cặp chất sau đây, cặp chất nào có phản ứng? Không có phản ứng?
a) Al và khí Cl2.
b) Al và HNO3 đặc, nguội.
c) Fe và H2SO4 đặc, nguội.
d) Fe và dung dịch Cu(NO3)2.
Viết các phương trình hóa học (nếu có)
Lời giải:
– Những cặp chất sau có phản ứng: a và d
a) 2Al + 3Cl2 → 2AlCl3
d) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
– Những cặp chất sau không có phản ứng:
Al + HNO3 đặc nguội
Fe + H2SO4 đặc nguội.
Do Al và Fe bị thụ động hóa trong môi trường HNO3 đặc nguội và H2SO4 đặc nguội
Bài 3 (trang 69 SGK Hóa 9)
Có 4 kim loại A, B, C, D đứng sau Mg trong dãy hoạt động hóa học. Biết rằng:
– A và B tác dụng với dung dịch HCl giải phóng hiđro.
– C và D không phản ứng với dung dịch HCl.
– B tác dụng với dung dịch muối A và giải phóng A.
– D tác dụng với dung dịch muối C và giải phóng C.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hóa học giảm dần).
a) B, D, C, A
b) D, A, B, C
c) B, A, D, C
d) A, B, C, D
e) C, B, D, A
Lời giải:
A, B tác dụng với HCl và C, D không phản ứng với HCl ⇒ A,B hoạt động mạnh hơn B, C
B tác dụng với dung dịch muối A và giải phóng A ⇒ B hoạt động mạnh hơn A
D tác dụng với dung dịch muối C và giải phóng C ⇒ D mạnh hơn C
⇒Sắp xếp theo chiều hoạt động hóa học giảm dần là: B, A, D, C
Phương án c đúng.
Bài 4 (trang 69 SGK Hóa 9)
Hoàn thành sơ đồ phản ứng:
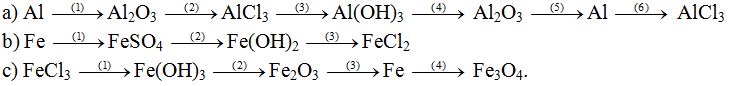
Lời giải:

Bài 5 (trang 69 SGK Hóa 9)
Cho 9,2g một kim loại A phản ứng với khí clo dư tạo thành 23,4g muối. Hãy xác định kim loại A, biết rằng A có hóa trị I.
Lời giải:
Gọi nguyên tử khối của kim loại A là A.
Phương trình hóa học của phản ứng:
2A + Cl2 → 2ACl
mA = 9,2g, mACl = 23,4g.
Có nA = nACl

⇒ 9,2 x (A + 35,5) = A x 23,4.
⇒ A = 23. Vậy kim loại A là Na.
Bài 6 (trang 69 SGK Hóa 9)
Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Lời giải:
a) PTHH:

b) Cứ 1 mol Fe phản ứng tạo thành 1mol Cu thì khối lượng thanh Fe tăng 64 – 56 = 8 (g)
Có x mol Fe phản ứng tăng: 2,58 – 2,5 = 0,08 (g)
![]()
nFeSO4 = 0,01 mol ⇒ mFeSO4 = 0,01.152 = 1,52 (g)
mdd CuSO4 = D . V = 1,12.25 = 28 (g)

⇒ CuSO4 dư → nCuSO4 dư = 0,026 – 0,01 = 0,016 (mol)
Chất sau phản ứng là: FeSO4 và CuSO4 dư
mCuSO4 dư = 0,016.160 = 2,56 (g)
mdd sau pư = 28 + 2,5 – 2,58 = 27,92 (g)

Bài 7 (trang 69 SGK Hóa 9)
Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc.
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Lời giải:
a) Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑ (1)
Fe + H2SO4 → FeSO4 + H2 ↑ (2)
b) ![]()
nAl = x mol; nFe = y mol.
Theo pt (1) nH2 = . nAl =
. x mol
Theo pt (2) nH2 = n Fe = y mol
nH2 = x + y = 0,025 mol.
mhh = 27x + 56y = 0,83.
Giải hệ phương trình ta có: x =0,01; y= 0,01
mAl = 0,01 x 27 = 0,27g
mFe = 0,01 x 56 = 0,56g

Trắc nghiệm Hóa học 9 Bài 22 (có đáp án)
Câu 1: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al)
B. Bạc (Ag)
C. Đồng (Cu)
D. Magie (Mg)
Đáp án: B
Câu 2: Trong các kim loại sau đây, kim loại dẻo nhất là:
A. Đồng (Cu)
B. Chì (Pb)
C. Bạc (Ag)
D. Vàng (Au)
Đáp án: D
Câu 3: Để làm sạch mẫu chì bị lẫn kẽm, ngươì ta ngâm mẫu chì này vào một lượng dư dung dịch:
A. ZnSO4
B. Pb(NO3)2
C. CuCl2
D. Na2CO3
Đáp án: B
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb.
Câu 4: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên:
A. Zn
B. Fe
C. Mg
D. Ag
Đáp án: B
Fe + CuCl2 → FeCl2 + Cu
Câu 5: Kim loại vừa tác dụng với dd HCl vừa tác dụng được với dung dịch KOH:
A. Fe, Al
B. Ag, Zn
C. Al, Cu
D. Al, Zn
Đáp án: D
Câu 6: Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hiđro:
A. K, Ca
B. Zn, Ag
C. Mg, Ag
D. Cu, Ba
Đáp án: A
Câu 7: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Đáp án: D
Fe + CuSO4 → FeSO4 + Cu
Hiện tượng: Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 8: Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%.
B. 4,0%.
C. 23,0%.
D. 5,8%.
Đáp án: B

Câu 9: Cho 4,6 g một kim loại M (hoá trị I) phản ứng với khí clo tạo thành 11,7g muối. M là kim loại nào sau đây:
A. Li
B. K
C. Na
D. Ag
Đáp án: C
2M + Cl2 → 2MCl
Bảo toàn khối lượng có :
mclo = 11,7 – 4,6 = 7,1 gam → nclo = 7,1 :71 = 0,1 mol
Theo PTHH có nM = 2.nclo = 0,2 mol → MM = 4,6 : 0,2 = 23 (g/mol).
Vậy kim loại cần tìm là Na.
Câu 10: Nhúng một lá sắt vào dung dịch đồng sunfat sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,2g. Khối lượng đồng bám vào lá sắt là:
A. 0,2g
B. 1,6g
C. 3,2g
D. 6,4g
Đáp án: B
![]()
Khối lượng lá sắt tăng = mCu sinh ra – mFe phản ứng → 64x – 56x = 0,2 → x = 0,025 mol
mCu sinh ra = 64.0,025 = 1,6 gam.
Câu 11: Hoà tan 9 g hợp kim nhôm – magiê vào dung dịch H2SO4 dư thu được 10,08 lít khí H2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50%
B. 40% và 60%
C. 60% và 40%
D. 39% và 61%
Đáp án: C
Gọi số mol của Al và Mg là x và y mol
mhợp kim = 9 gam → 27x + 24y = 9 (1)
PTHH:

Theo bài ra có nH2 = 0,45 mol → 1,5 x + y = 0,45 (2)
Từ (1) và (2) có: x = 0,2 và y = 0,15 mol

Câu 12: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là:
A. 32%
B. 54%
C. 19,6%
D. 18,5%
Đáp án: C
Số mol Fe = 22,4 : 56 = 0,4 mol

Câu 13: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K , Al , Mg , Cu , Fe
B. Cu , Fe , Mg , Al , K
C. Cu , Fe , Al , Mg , K
D. K , Cu , Al , Mg , Fe
Đáp án: C
Câu 14: Có 3 lọ đựng 3 chất riêng biệt Mg, Al, Al2O3 để nhận biết chất rắn trong từng lọ chỉ dùng 1 thuốc thử là:
A. Nước
B. Dung dịch HCl
C. Dung dịch KOH
D. Dung dịch H2SO4 loãng.
Đáp án: C
Sử dụng dung dịch KOH
+ Nếu chất rắn tan và có khí thoát ra → Al
2Al + 2H2O + 2KOH → 2KAlO2 + 3H2
+ Nếu chất rắn tan, không có khí thoát ra → Al2O3
Al2O3 + 2KOH → 2KAlO2 + H2O
+ Nếu chất rắn không tan là Mg.
Câu 15: Cho một lá Fe vào dung dịch CuSO4, sau một thời gian lấy lá sắt ra, khối lượng dung dịch thay đổi như thế nào?
A. Tăng so với ban đầu
B. Giảm so với ban đầu
C. Không tăng, không giảm so với ban đầu
D. Tăng gấp đôi so với ban đầu
Đáp án: B
******************
Trên đây là nội dung bài học Hóa học 9 Bài 22: Luyện tập chương 2: Kim loại do biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Luyện tập chương 2: Kim loại. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường
Bạn đang xem: Hóa học 9 Bài 22: Luyện tập chương 2: Kim loại – Giải bài tập SGK Hóa học 9 Bài 2
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp



