Phương trình điện li – Cách viết và các dạng bài tập lớp 11
Phương trình điện li là một trong những chuyên đề khá quan trọng trong chương trình hóa học lớp 11. Việc hiểu các định nghĩa về sự điện li cũng như một số phương trình điện li cơ bản luôn là điều cần thiết và bắt buộc trước khi giải một bài tập hóa học. Ở bài viết này sẽ làm rõ cho các bạn tất tần tật lý thuyết về chương này cũng như những bài tập hóa học quan trọng.
Nội dung chính
Điện li là gì ?
Điện li hay ion hóa là quá trình một nguyên tử hay phân tử tích một điện tích âm hay dương bằng cách nhận thêm hay mất đi electron để tạo thành các ion, thường đi kèm các thay đổi hóa học khác. Ion dương được tạo thành khi chúng hấp thụ đủ năng lượng (năng lượng này phải lớn hơn hoặc bằng thế năng tương tác của electron trong nguyên tử) để giải phóng electron, những electron được giải phóng này được gọi là những electron tự do.
Bạn đang xem: Phương trình điện li – Cách viết và các dạng bài tập lớp 11
Năng lượng cần thiết để xảy ra quá trình này gọi là năng lượng ion hóa. Ion âm được tạo thành khi một electron tự do nào đó đập vào một nguyên tử mang điện trung hòa ngay lập tức bị giữ lại và thiết lập hàng rào thế năng với nguyên tử này, vì nó không còn đủ năng lượng để thoát khỏi nguyên tử này nữa nên hình thành ion âm.
Nguyên tắc khi viết phương trình điện li
1. Chất điện li mạnh
Chất điện li yếu là chất mà khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Chúng ta cùng tìm hiểu một số phương trình điện li của các chất điện li mạnh đặc trưng dưới đây:
+) Axit: HCl, H2SO4 , HNO3 …
- HCl → H+ + Cl-
- H2SO4 → 2H+ + SO4
+) Bazo: NaOH, Ca(OH)2 …
- NaOH → Na+ + OH-
- Ca(OH)2 → Ca2+ + 2OH-
+) Muối: NaCl, CaCl2 , Al2(SO4)3
- NaCl → Na+ + Cl-
- CaCl2 → Ca2+ + 2Cl-
- Al2(SO4)3 → 2Al3+ + 3SO4
2. Chất điện li yếu
Ngược lại với chất điện li mạnh thì chất điện li yếu là chất mà khi chúng được hòa tan trong nước, sẽ có một số ít phần từ hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phần tử trong dung dịch.Các chất điện li yếu thường gặp là: axit yếu, bazo yếu, các muối không tan, muối dễ bị phân hủy,..
Ví dụ: HF, H2S, H2SO3,CH3COOH, NH3, Fe(OH)2, Cu(OH)2, AgCl, PbSO4… Và đặc biệt H2O là một chất điện li yếu.
Tổng hợp phương trình điện li thường gặp
Ngoài việc nắm vững kĩ năng và định nghĩa ở phần trên, thì kiến thức một số phương trình điện li thường gặp cũng khá quan trọng, giúp các bạn đỡ được nhầm lẫn. Cùng tìm hiểu qua một số chất sau đây nhé !
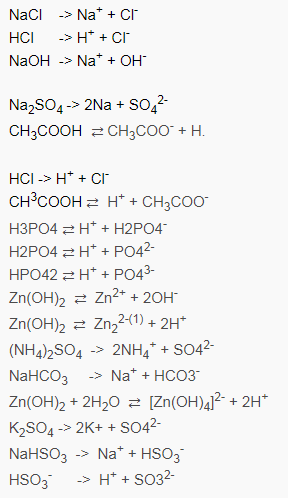

Phương pháp giải bài tập phương trình điện li
Dạng 1: Chất điện li mạnh
Bước 1: Viết phương trình điện li của chất điện li mạnh
Dựa vào bảng phương trình trên cùng với dữ kiện đề bài, ta thiết lập một số phương trình liên quan đến các chất có trong đề bài. Một trong những chất điện li mà chúng ta khá hay quên đó chính là H2O. Đây là bước cực kì quan trọng quyết định trực tiếp đến kết quả tính toán của bài tập.

Bước 2: Xác định nồng độ mol của ion
- Tính số mol của chất điện li có trong dung dịch
- Viết phương trình điện li chính xác, biểu diễn số mol lên các phương trình điện li đã biết
- Tính nồng độ mol của ion
Ví dụ: Hòa tan 12,5 gam tinh thể CuSO4.5H2O trong nước thành 200 ml dung dịch . Tính nồng độ mol các ion trong dung dịch thu được .
Lời giải:
a.) nCuSO4. 5H2O = 12,5/250 = 0,05 (mol)
CuSO4.5H2O → Cu2+ + SO4 2- + 5H2O
0,05 0,05 0,05 (mol)
[ Cu2+] = [SO42-] = 0.05/0.2 = 0.25M
Dạng 2: Định luật bảo toàn điện tích
Bước 1: Phát biểu định luật
Trong một dung dịch chứa hoàn toàn các chất điện li, thì tổng số mol của điện tích âm luôn bằng tổng số mol của điện tích dương. (Luôn luôn bằng nhau)

Ví dụ: Dung dịch A chứa Na+ 0,1 mol , Mg2+ 0,05 mol , SO4 2- và 0,04 mol còn lại là Cl- . Tính khối lượng muối
trong dung dịch.
Giải: Vẫn áp dụng các công thức trên về cân bằng điện tích ta dễ dàng tính được khối lượng muối trong dung dịch là: m = 11.6 gam.
Dạng 3: Bài toán về chất điện li
Bước 1: Viết phương trình điện li
Như chúng ta đã tìm hiểu cách viết phương trình điện li rất chi tiết ở phía trên. Ở đây chúng ta không cần nêu lại nữa mà tiến hành sang bước 2 đó là …
Bước 2: xác định độ điện li
Áp dụng công thức độ điện li dưới đây nhé:

Sau đó xử dụng phương pháp 3 dòng thật hiệu quả:

Biến số anla có thể quyết định nó là chất điện li mạnh, yếu hay là chất không điện li. Cụ thể là:
- α = 1 : chất điện li mạnh
- 0 < α < 1 : chất điện li yếu
- α = 0 : chất không điện li
Ví dụ: Điện li dung dịch CH3COOH 0,1M được dung dịch có [H+] = 1,32.10-3 M. Tính độ điện li α của axit CH3COOH.
Lời giải: Bài tập này khá đơn giản và được trích trong sách chinh phục hóa hữu cơ của Nguyễn Anh Phong. húng ta làm như sau với ghi nhớ rằng đề bài cho chất điện li và đã có nồng độ nên mới theo hướng dưới đây:

Dạng 4: Xác định hằng số điện li
Để làm bài toán này ta chia thành các bước như sau: Xác định hằng số của axit và xác định hằng số điện li của bazơ


Ví dụ: Tính nồng độ mol ion H+ của dung dịch CH3COOH 0,1M , biết hằng số phân li của axit Ka = 1,75.10-5.
==> Đề bài khá đơn giản khi cho biến đầy đủ dữ kiện, đề bài không quá lách léo và ta phải thực hiện như sau để tính được nồng độ ion H+:

Dạng 5: Tính độ PH dựa vào nồng độ H+
Bước 1: Tính độ Ph của Axit
- Tính số mol axit điện li axit
- Viết phương trình điện li axit
- Tính nồng độ mol H+ sau đó suy ra nồng độ mol của PH bằng mối liên hệ giữa hai nồng độ này qua hàm log.
![]()
Bước 2: Xác định độ PH của bazo
Ta thực hiện theo các bước sau:
- Tính số mol bazo của điện li
- Viết phương trình điện li bazo
- Tính nồng độ mol OH- rồi suy ra [H]+
- Tính độ PH
Ví dụ 1: Tính pH của dung dịch chứa 1,46 gam HCl trong 400 ml .
Ví dụ 2: Tính pH của dung dịch chứa 0,4 gam NaOH trong 100 ml .
Ví dụ 3: Tính pH của dung dịch tạo thành khi trộn 100 ml dung dịch HCl 1M với 400 ml dung dịch NaOH 0,375 M
Lời giải cho các bài tập trên
Ví dụ 1:
nHCl = 0,04 (mol)
HCl → H+ + Cl-0,04 0,04 (mol) .[H+] = 0,04/0,4 = 0,1 (M).
pH = – lg[H+] = 1.
Ví dụ 2:
nNaOH = 0,4/40 = 0,01 (mol) .
NaOH → Na+ + OH- . 0,01 0,01 (mol) . [OH-] = 0,01/0,1 = 0,1 (M) .
Ta có : [H+].[OH-] = 10-14 → [H+] = 10-13 → pH = 13 .
Ví dụ 3: Đáp số pH = 13.
Dạng 6: Xác định nồng độ mol dựa vào độ pH
Bài toán trải qua hai quá trình tính nồng độ mol của axit và nồng độ mol của bazo. Và lưu ý một số điểm như sau:
- pH > 7 : môi trường bazo .
- pH < 7 : môi trường axit .
- Ph = 7 : môi trường trung tính .
Ví dụ: Cần bao nhiêu gam NaOH để pha chế 300 ml dung dịch có pH = 10.
Lời giải:

Dạng 7: Axit, bazo và sự lưỡng tính theo hai lý thuyết
Đây là một dạng toán khá ít gặp tuy nhiên các em cần nắm vững hai lý thuyết A – rê – ni – ut về sự điện li và thuyết Bron – stêt về thuyết proton. Hai thuyết này có sự định nghĩa hoàn toàn khác nhau về thế nào là chất bazơ và thế nào là chất axit.
Ví dụ:
Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một axit, ở phản ứng nào nước
đóng vai trò là một bazo (theo Bron – stêt).
1. HCl + H2O → H3O+ + Cl-
2. Ca(HCO3)2 → CaCO3 + H2O + CO2 .
3. CuSO4 + 5H2O → CuSO4.5H2O .
Lời giải:
1. HCl → H+ + Cl-
H2O + H+ → H3O+
Do đó H2O nhận proton H+ nên thể hiện tính bazo .
3. NH3 + H+OH → NH4+
Do đó H2O nhường proton H+ nên thể hiện tính axit.
✅ Ghi nhớ: Công thức tính số liên kết pi.
Các dạng bài tập hóa học chương điện li
Bài tập 1. Viết các phương trình điện li cho các trường hợp sau: NaCl; HCl; KOH; H2SO4; AlCl3; (NH4)2CO3
Bài tập 2. Viết các phương trình điện li và tính số mol các ion sinh ra trong các trường hợp sau:
a. dd chứa 0,2 mol HNO3
b. dd chứa 0,5 mol Na3PO4
c. dd chứa 2 mol NaClO
d. dd chứa 2,75 mol CH3COONa
Bài tập 3. Cho các dung dịch sau:
a. 200ml dd chứa 0,25 mol Na2S
b. 500ml dd chứa 8,5g NaNO3
c. dung dịch Ba(OH)20,3M
d. dd Al2(SO4)30,15M
Viết các phương trình điện li và tính nồng độ mol của các ion trong dung dịch
Bài tập 4. Một dung dịch có chứa 0,2 mol K+; 0,3 mol Mg2+; 0,45 mol và x mol .
a. Tính x?
b. Cô cạn dung dịch thu được m gam muối khan. Tính m?
Bài tập 5. Hòa tan hai muối X, Y vào nước được 1 lit dung dịch chứa: [Zn2+] = 0,2M; [Na+] = 0,3M; = 0,15M; = p (M).
a. Tính p
b. Tìm công thức hai muối X, Y ban đầu. Tính khối lượng mỗi muối đem hòa tan.
Bài tập 6. Chỉ ra các chất sau đây là chất điện li mạnh hay điện li yếu trong nước. Viết phương trình điện li của chúng? NaBr; HClO; CaCl2; CH3COOH; K2CO3; Mg(OH)2.
Bài tập 7. Hãy sắp xếp dung dịch các chất sau (cùng nồng độ) theo chiều tăng dần khả năng dẫn điện: CH3COOH; AlCl3; Al2(SO4)3; AgNO3; Ba(OH)2.
Bài tập 8. Tính nồng mol của các ion trong dung dịch trong các trường hợp sau:
a. dd Na2SO30,3M (=1)
b. dd HF 0,4M (= 0,08)
c. dd HClO 0,75 (= 5%)
d. dd HNO20,5M (= 6%)
Bài tập 9. Cho 200 ml dung dịch HNO3 có pH=2, nếu thêm 300 ml dung dịch H2SO4 0,05 M vào dung dịch trên thì dung dịch thu được co pH bằng bao nhiêu?
A. 1,29
B. 2,29
C. 3
D.1,19
Bài tập 10. Có dung dịch H2SO4 với pH=1,0 khi rót từ 50 ml dung dịch KOH 0,1 M vào 50 ml dung dịch trên. Tính nồng độ mol/l của dung dịch thu được?
A. 0,005 M
B. 0,003 M
C. 0,06 M
D. Kết quả khác
Bài tập 11. Dung dịch chứa 0,063 g HNO3 trong 1 lít có độ pH là:
A. 3,13
B. 3
C. 2,7
D. 6,3
E. 0,001
Bài tập 12. Theo Areniut những chất nào sau đây là Hiđroxit lưỡng tính
A. Al(OH)3 , Fe(OH)2
B. Cr(OH)2 , Fe(OH)2.
C. Al(OH)3 , Zn(OH)2.
D. Mg(OH)2, Zn(OH)2.
Bài tập 13. Theo Areniut phát biểu nào sau đây là đúng?
A. chất có chứa nhóm OH là Hiđroxit.
B. chất có khả năng phân li ra ion trong nước là axit.
C. chất có chứa hiđrô trong phân tử là axit.
D. chất có chứa 2 nhóm OH là hiđrôxit lưỡng tính.
Bài tập 14. Phát biểu nào sau đây không đúng ? Phản ứng trao đổi ion trong dd chất điện li xảy ra khi
Có phương trình ion thu gọn
B. Có sự giảm nồng độ một số các ion tham gia phản ứng
Có sản phẩm kết tủa, chất khí, chất điện li yếu.
D. Các chất tham gia phải là chất điện li
Vậy là qua rất nhiều bài tập cũng như ví dụ, chúng ta đã tìm hiểu cách viết phương trình điện li cũng như một số bài tập cực hay liên quan đến chuyên đề này. Còn thắc mắc gì nữa về chương trình hóa học 11 nói chung cũng như chương điện li 3 nói riêng thì các em có thể để lại bình luận xuống bên dưới bài viết này. Chúc các em học tốt.
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp





