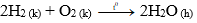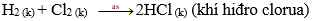Hóa học 9 Bài 25: Tính chất của phi kim được biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 25
I. Phi kim có những tính chất vật lí nào?
Ở điều kiện thường: Phi kim có thể tồn tại ở trạng thái rắn như C, S, P, Si, I2,…; trạng thái lỏng như: Br2; trạng thái khí như: O2, H2, N2, …
Phần lớn phi kim không dẫn điện, dẫn nhiệt và có nhiệt độ nóng chảy thấp.
Một số phi kim độc như clo, brom, iot.
II. Phi kim có những tính chất hóa học nào?
1. Tác dụng với kim loại
– Oxi tác dụng với kim loại tạo thành oxit
Ví dụ:
![]()
– Các phi kim khác tác dụng với kim loại tạo thành muối
Ví dụ:
![]()
2. Tác dụng với hiđro
– Oxi tác dụng với hiđro tạo thành hơi nước
Phương trình hóa học:
– Các phi kim khác (như C; S; Cl2; Br2…) tác dụng với hiđro tạo thành hợp chất khí
Ví dụ:
Khí hiđro clorua tan trong nước tạo thành axit clohiđric và làm quỳ tím hóa đỏ.
3. Tác dụng với oxi
Nhiều phi kim tác dụng với oxi tạo thành oxit axit
Ví dụ:

4. Mức độ hoạt động của phi kim
Mức độ hoạt động mạnh hay yếu của phi kim thường được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro.
Các phi kim như flo, oxi, clo là những phi kim hoạt động hóa học mạnh, trong đó flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.
Giải bài tập SGK Hóa học 9 Bài 25
Bài 1 (trang 76 SGK Hóa 9)
Hãy chọn câu đúng:
a) Phi kim dẫn điện tốt.
b) Phi kim dẫn nhiệt tốt.
c) Phi kim chỉ tồn tại ở hai trạng thái rắn, khí.
d) Phi kim dẫn điện, dẫn nhiệt kém.
Lời giải:
Phương án đúng: d.
Bài 2 (trang 76 SGK Hóa 9)
Viết các phương trình hóa học của S, C, Cu, Zn vơí khí O2. Cho biết các oxit tạo thành thuộc loại nào. Vết công thức các axit hoặc bazơ tương ứng với mỗi oxit đó.
Lời giải:
Phương trình hóa học:
a) S + O2 → SO2 (to)
b) C + O2 → CO2
c) 2Cu + O2 → 2CuO
d) 2Zn + O2 → 2ZnO
Oxit tạo thành là oxit axit:
SO2 axit tương ứng là H2SO3.
CO2 axit tương ứng là H2CO3.
Oxit tạo thành là oxit bazơ :
CuO bazơ tương ứng là Cu(OH)2.
ZnO là oxit lưỡng tính; bazơ tương ứng là Zn(OH)2, axit tương ứng: H2ZnO2
Bài 3 (trang 76 SGK Hóa 9)
Viết phương trình hóa học khi cho hiđro phản ứng với:
a) clo.
b) lưu huỳnh.
c) brom.
Cho biết trạng thái các chất tạo thành.
Lời giải:
Phương trình hóa học:
a) H2 (k) + Cl2 (k) → 2HCl(k) (HCl ở trạng thái khí, không màu)
b) S + H2 (k) → H2S (k) (H2S ở trạng thái khí, không màu, có mùi trứng thối)
c) H2 + Br2 → 2HBr(to) (HBr ở trạng thái khí, không màu)
Bài 4 (trang 76 SGK Hóa 9)
Viết các phương trình hóa học giữa cặp chất sau đây (ghi rõ điều kiện, nếu có):
a) Khí flo và hiđro.
b) Lưu huỳnh và oxi.
c) Bọt sắt và bột lưu huỳnh.
d) Cacbon và oxi.
e) Khí hiđro và lưu huỳnh.
Lời giải:
Phương trình hóa học:
a) H2 + F2 → 2HF (k)
b) S + O2 → SO2(to)
c) Fe + S → FeS (to).
d) C + O2 → CO2(to).
e) H2 + S → H2S.(to)
Bài 5 (trang 76 SGK Hóa 9)
Cho sơ đồ biểu diễn chuyển đổi sau:
Phi kim → oxit axit → oxit axit → axit → muối sunfat tan → muối sunfat không tan.
a) Tìm công thức các chất thích hợp để thay cho tên chất trong sơ đồ.
b) Viết các phương trình hóa học biểu diễn chuyển hóa trên.
Lời giải:
a) Sơ đồ phản ứng:
S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4.
b) Phương trình phản ứng:

Bài 6 (trang 76 SGK Hóa 9)
Nung hỗn hợp gồm 5,6g sắt và 1,6g lưu huỳnh trong môi trường không có không khí thu được hỗn hợp chất rắn A. Cho dung dịch HCl 1M phản ứng vừa đủ với A thu được hỗn hợp khí B.
a) Hãy viết các phương trình hóa học.
b) Tính thể tích dung dịch HCl 1M đã tham gia phản ứng.
Lời giải:
nFe = 0,1 mol; nS = 0,05 mol
a) Phương trình phản ứng:
Fe + S → FeS (1)
Theo pt: nFe pư = nS = 0,05 mol ⇒ nFe dư = 0,1 – 0,05 = 0,05mol
nFeS = nS = 0,05 mol
Nên hỗn hợp chất rắn A có Fe dư và FeS
Fe + 2HCl → FeCl2 + H2 ↑ (2)
FeS + 2HCl → FeCl2 + H2S ↑ (3)
b) Dựa vào phương trình phản ứng (2) và (3), ta có:
nHCl = 2.nFe + 2.nFeS = 2. 0,05 + 2. 0,05 = 0,2 mol
VHCl = 0,2 /1 = 0,2 lít.
Trắc nghiệm Hóa học 9 Bài 25 (có đáp án)
Câu 1: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. lỏng và khí.
B. rắn và lỏng.
C. rắn và khí.
D. rắn, lỏng, khí.
Đáp án: D
Câu 2: Dãy gồm các phi kim thể khí ở điều kiện thường
A. S, C, N2, Cl2.
B. C, S, Br2, Cl2.
C. Cl2, H2, N2, O2.
D. Br2, P, N2, O2.
Đáp án: C
Câu 3: Dãy gồm các nguyên tố phi kim là
A. C, S, O, Na.
B. Cl, C, P, S.
C. P, S, Si, Ca.
D. K, N, P, Si.
Đáp án: B
Câu 4: Ở điều kiện thường, phi kim ở thể lỏng là
A. oxi.
B. brom.
C. clo.
D. cacbon.
Đáp án: B
Câu 5: Dãy phi kim tác dụng với oxi tạo thành oxit axit
A. S, C, P.
B. S, P, Cl2.
C. Si, P, Br2.
D. C, Cl2, Br2.
Đáp án: A
Chú ý: Cl2 và Br2 không tác dụng trực tiếp với oxi.
Câu 6: Dãy phi kim tác dụng được với nhau là
A. S, Cl2, O2.
B. H2, S, O2.
C. Br2, C, O2.
D. N2, S, O2.
Đáp án: B

Câu 7: Độ tan của chất khí tăng nếu
A. tăng nhiệt độ, tăng áp suất.
B. tăng nhiệt độ, giảm áp suất.
C. giảm nhiệt độ, tăng áp suất.
D. giảm nhiệt độ, giảm áp suất.
Đáp án: C
Câu 8: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với
A. hiđro hoặc với kim loại.
B. dung dịch kiềm.
C. dung dịch axit.
D. dung dịch muối.
Đáp án: A
Câu 9: Dãy các chất tác dụng với hiđro tạo thành hợp chất khí là
A. C, Br2, S, Cl2.
B. C, O2, Na, Si.
C. Si, K, P, Cl2.
D. P, Ca, Cl2, S.
Đáp án: A
Các phi kim như C, S, Cl2, Br2 … tác dụng với hiđro tạo thành hợp chất khí.
Câu 10: Đốt cháy hoàn toàn 2,8 gam hỗn hợp cacbon và lưu huỳnh cần 3,36 lít O2 (đktc). Khối lượng mỗi chất trong hỗn hợp lần lượt là
A. 0,2 gam và 0,8 gam.
B. 1,2 gam và 1,6 gam.
C. 1,3 gam và 1,5 gam.
D. 1,0 gam và 1,8 gam.
Đáp án: B
Số mol O2 = 3,36 : 22,4 = 0,15 mol
Phương trình hóa học:
![]()
Gọi số mol oxi tham gia phản ứng (1) là x mol
→ số mol oxi tham gia phản ứng (2) là (0,15 – x) mol
Theo (1) ta có: nC = nO2 (1) = x mol
Theo (2) ta có: nS = nO2 (2) = (0,15 – x) mol
Theo bài ra khối lượng hỗn hợp C và S là 2,8 gam
→ 12x + 32(0,15 – x) = 2,8
⇔ 20x = 2 ⇔ x = 0,1 mol
Vậy khối lượng C là 12.x = 12.0,1 = 1,2 gam; khối lượng S là 2,8 – 1,2 = 1,6 gam.
******************
Trên đây là nội dung bài học Hóa học 9 Bài 25: Tính chất của phi kim do biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Tính chất của phi kim. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường
Đăng bởi: Thcs-thptlongphu.edu.vn
Chuyên mục: Tổng hợp